Introduction
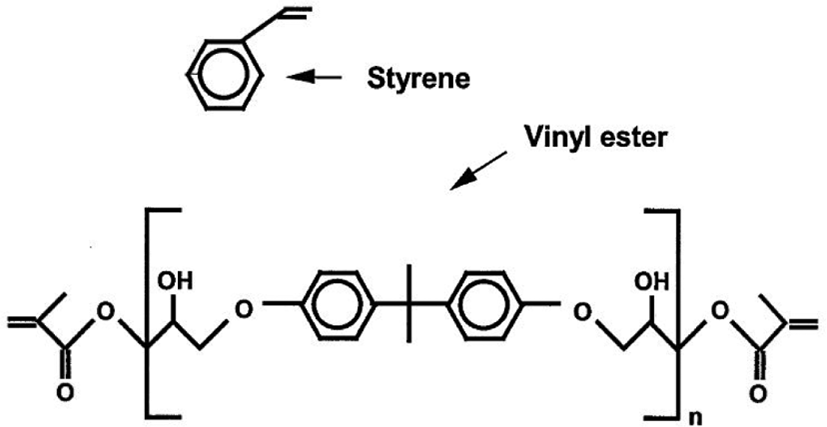
불포화에스터(Unsaturated Polyester, UPE) 수지는 스티렌 모노머(Styrene Monomer, SM)를 적정 비율로 혼합하여 섬유강화복합플라스틱(Fiber Reinforced Plastics, FRP) 소재의 바인더 수지로 일반적으로 많이 사용되며, 적절한 기계적 성질과 내구성, 치수안정성, 저가의 경제성 및 용이한 제조공정으로 여러 가지 장점을 가지고 있다. 그러나 UPE 수지는 올리고머의 반복단위 안에 이중결합이 있기 때문에 경화될 경우, 취성이 증가하여 충격에 약한 단점이 있어 이를 개선하기 위한 많은 연구가 진행되었다. 비닐에스터(Vinyl-Ester, VE)수지는 UPE 수지와 비슷한 화학구조를 가지고 있으나, Figure 1에서 보이는 바와 같이 일반적으로 비스페놀-A 타입에 기반으로 하는 디메타크릴레이트 올리고머(dimethacrylate oligomer)를 사용하며 경화반응에 관여하는 이중결합이 반복단위의 바깥에 존재하고 또한 에폭시 수지에 많이 사용되는 비스페놀-A를 이용하기 때문에 반복단위의 수를 조절함으로서 경화된 수지의 강인성을 크게 개선할 수 있다. 따라서 VE수지는 에폭시 수지의 뛰어난 기계적 특성과 열적 성질을 포함하면서도 UPE의 라디칼 중합에 의한 빠른 경화특성을 동시에 가지고 있다고 볼 수 있다. 더구나 UPE 수지와는 달리 가수분해에 취약한 에스터 관능기(-COO-)가 적기 때문에 내화학성이 뛰어난 특징을 가지게 될 수 있으므로, 이러한 여러 가지 장점으로 인하여 고성능의 FRP 복합재료의 바인더 수지를 요구하는 경우에 많이 사용된다.1-4
VE 수지의 경화반응은 제조공정에 매우 중요한 영향을 미치게 되므로 이에 대한 많은 연구가 진행되어 왔다. 특히 열분석 방법을 이용하여 개시제 농도의 영향, 온도의 영향, SM 조성비 및 산소가 경화반응에 미치는 영향 등에 대하여 많은 연구가 이루어져 왔다.5-8 경화반응은 VE/SM 혼합물의 라디칼 반응에 의하여 일어나므로 반응은 SM 라디칼에 의한 단일중합체 및 공중합체 생성반응과 VE 라디칼에 의한 단일중합체 및 공중합체 생성반응 등의 매우 복잡한 반응이 혼재하여 일어나게 되지만 일반적으로는 저온에서는 반응초기에 먼저 VE 수지의 반응이 상대적으로 먼저 일어나고 이어서 SM의 반응이 뒤따르는 것으로 알려져 있다.9,10 그러나 아직도 주어진 조성비에 대한 반응 kinetic에 대한 연구는 많은 경우 잘 알려져 있지 않다.
VE 수지의 반응 kinetics는 반응 생성물의 미세구조에 많은 영향을 미치게 되고 이는 결국 최종 제품의 물성에 큰 영향을 미치게 된다. 따라서 본 연구에서는 주어진 조성비를 가지는 VE/SM 혼합물에 대하여 비등온 DSC를 이용한 열경화 거동을 살펴보고 이로부터 해석되는 열경화 모델을 적용하여 경화속도식을 도출하고, 추 후 진행되는 FRP 복합재료 공정개발에 특히 중요한 경화거동에 관한 연구의 기초 데이터를 축적하고자 하였다.
Experimental
실험에 사용된 VE 수지는 에폭시 타입의 비스페놀-A를 기반으로 하는 Epovia® KRF-1001 (Polynt Composites)로서 VE/SM=60/40의 혼합물로 구성되어 있다. VE는 모듈러스, Tg, 강도 및 내구성을 부여하고, 스티렌 모노는 반응성 희석제로서, 점도조절과 젖음성(wettability)의 조정 역할을 하게 된다. 반응개시제는 메칠에칠케톤 퍼옥사이드(methyl ethyl ketone peroxide, MEKP)로서 디메칠프탈레이트(dimethyl phthalate)에 약 10% 활성 산소용액으로 판매되는 악조노벨사(Akzo Nobel)의 Butanox® M-60이 사용되었다. 반응촉진제로는 Cobalt Octoate (CoOct)가 사용되었으며 수지의 0.4% 되도록 미리 혼합되어 있는 것을 사용하였다. 실험에 사용된 바인더 수지의 경화시스템 포뮬레이션(formulation)을 Table 1에 나타내었다. 비닐에스터 수지 및 반응개시제는 국내 FRP 전문회사인 ㈜수성의 도움을 받아 입수하였고, 받은 재료는 냉장 보관하여 상온 반응이 일어나지 않도록 하였다.
| Component | Concentration [phr] |
|---|---|
| Vinyl-Ester Resin (KRF-1001) | 100 |
| Initiator (Butanox® M-60) | 1.0 |
| Co-Octoate | 0.4 |
VE/SM 수지 100 part를 미리 정량하고, 여기에 반응개시제 1 part를 따로 정량하여 잘 혼합한 뒤, 그 중 약 10 mg의 샘플을 채취하여 비등온 DSC (Differential Scanning Calorimetry) 열분석 시험의 시료로 사용하였다. 반응개시제를 혼합한 시료의 가사시간(Pot life)은 약 20분 정도이므로 샘플시료는 가능한 빠른 시간 내에 알루미늄 샘플 팬에 밀봉하여 DSC 샘플 홀더에 장착하였다. 비등온 열분석을 위하여 질소분위기 하에서 온도를 5, 10, 15, 20 및 25°C/min의 승온속도로 상온에서 180°C까지 승온시키면서 온도변화에 따른 열량변화 곡선을 얻었다.
Results and Discussion
비닐에스터가 불포화비닐 에스터와 다른 점은 Figure 1에서 보듯이 프리폴리머 chain의 양 쪽에 탄소 이중결합(-C=C-)이 존재하고 –OH 관능기는 펜단트 그룹(pendant group)으로 존재한다는 것이다. -C=C-결합은 비닐 그룹으로 양 쪽에 존재하기 때문에 반응 도중에 가교 구조를 형성하게 된다. 반면에 혼합물 내에 존재하는 스티렌은 선형구조로 형성한다. 따라서 이러한 혼합물은 자유라디칼(free radical)에 의한 부가중합으로 반응이 진행되며, 잘 알려진 데로 1) 개시(Initiation), 2) 성장(Propagation), 및 3) 종결(Termination)의 3단계로 반응이 진행된다.
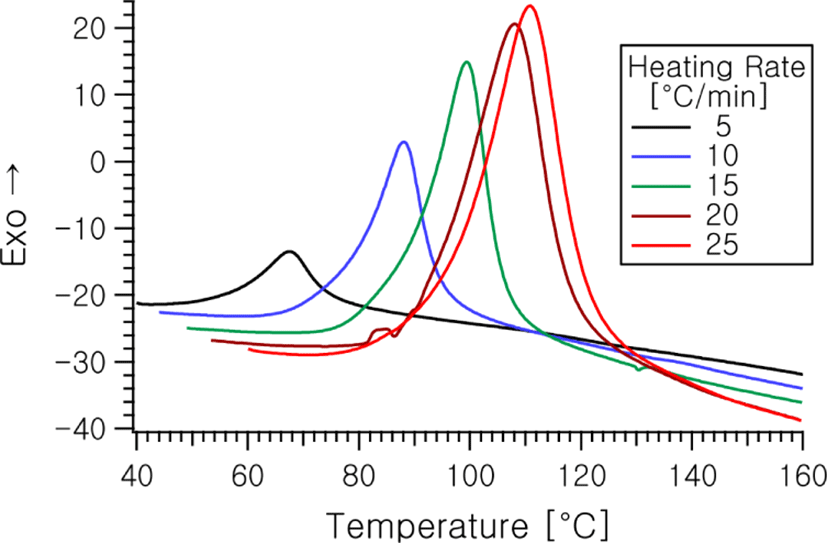
Figure 2에는 개시제 1% 혼합 샘플의 서로 다른 승온속도에 따른 DSC 열분석 곡선을 나타낸다. 그림에서 보아 잘 알 수 있듯이 최대 반응속도점의 온도, Tp는 승온속도가 빠를수록 열평형 도달시간으로 인하여 상대적으로 더 높은 온도로 이동하는 것을 관찰할 수 있다.
일반적으로 자유라디칼 중합에 대한 이론적으로 도출된 반응속도식에 따르면 중합속도는 식 (1)에 보이는 바와 같이 온도의 함수인 속도상수(kp), 모노머의 농도([M]), 및 자유라디칼의 농도에 따르게 된다.
이중에서 자유라디칼의 농도는 반응개시제의 농도, 분해속도, 분해효율, 촉매농도, 및 종결반응속도 등에 복합적으로 연계되기 때문에 매우 복잡한 반응의 복합된 형태로 일어나게 된다.5
따라서 정확한 반응기구가 알려지지 않은 반응속도식 연구에는 모델 속도식을 사용하는 많은 연구가 진행되었고, 최근에는 에폭시 및 비닐에스터 수지의 반응 거동에는 다음의 식 (2)에 표시된 바와 같이 일반적인 반응속도식으로부터 유도 되는 다양한 모델을 이용하는 속도식에 대한 연구가 진행되었다.8-10
여기서 α는 전환율이며, k는 아레니우스 (Arrehnius)식으로 나타낼 수 있는 반응속도상수이다. 전환율함수 f(α) 는 반응종류에 따라 다양한 형태의 모델식으로 표시된다.
비등온 DSC 열분석 실험으로부터 얻어진 곡선으로부터, 온도변화에 따른 전환율 α는 반응이 완결될 때까지의 총열량 (ΔHtotal)에 대한 일정온도에 이르기까지의 열량(ΔHT)의 비 ΔHT/ΔHtotal 로부터 얻어질 수 있다.
Figure 3에는 이와같이 하여 Figure 2로부터 얻어지는 온도에 따른 전환율의 변화를 나타낸다.
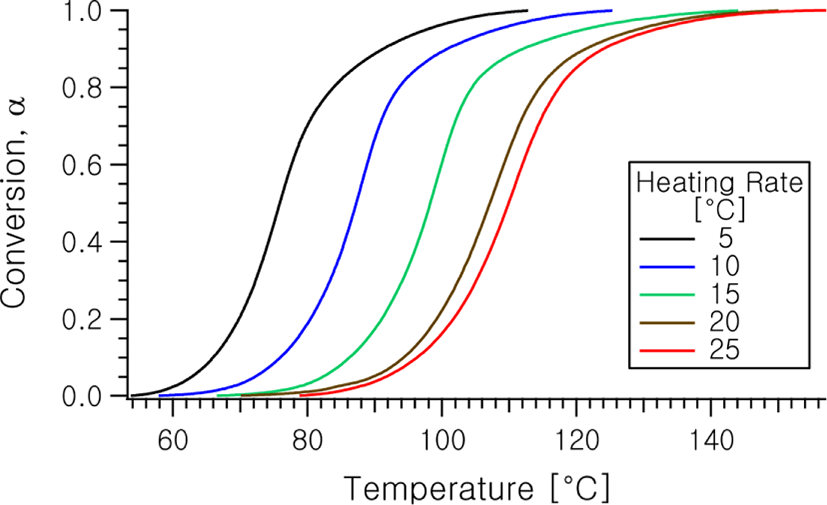
그림으로부터 잘 알 수 있듯이 일정한 승온속도에서의 전환율은 초기 낮은 값으로부터 완결될 때까지 S자 형태 (Sigmoid)로 변화하고 있음을 알 수 있으며, 이러한 형태의 모습은 전형적인 자동촉매 반응의 형태를 나타내는 것이다.
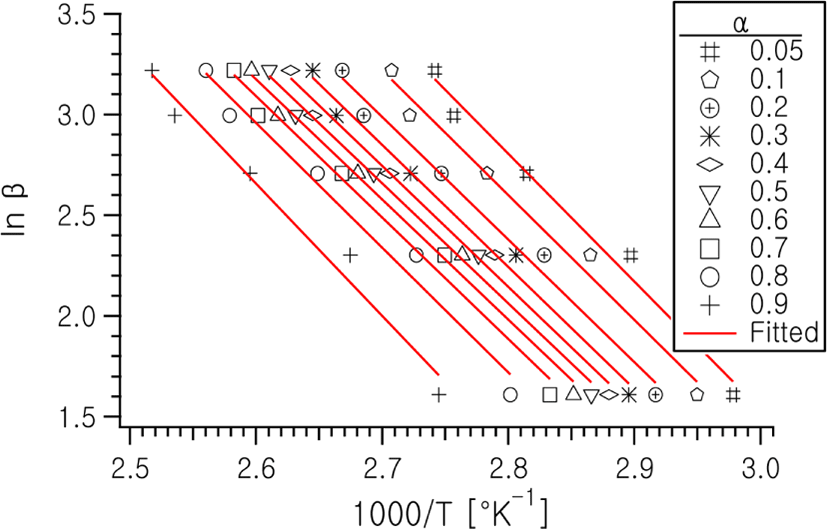
일정한 승온속도, β에서의 온도에 따른 반응속도는 β=dT/dt 이므로, 반응활성화 에너지는 일정 전환율에서의 활성화 에너지는 Flynn-Wall-Ozawa (FWO)식으로 잘 알려진 다음의 식 (3)을 이용하여 plot의 기울기로 부터 얻어질 수 있다.11,12
여기서 A는 빈도인자를 나타내며, Ea 활성화 에너지, R은 기체상수, T는 절대온도를 나타낸다.
Figure 4에는 전환율 0.05~0.9 구간에 이르기까지 각각의 승온속도에서 일정 α값에 이르는 온도를 찾아내어 를 plot한 결과를 나타낸다. 또한 이 그림의 기울기로부터 계산된 전환율에 따른 활성화 에너지의 변화를 Figure 5에 나타내었다.
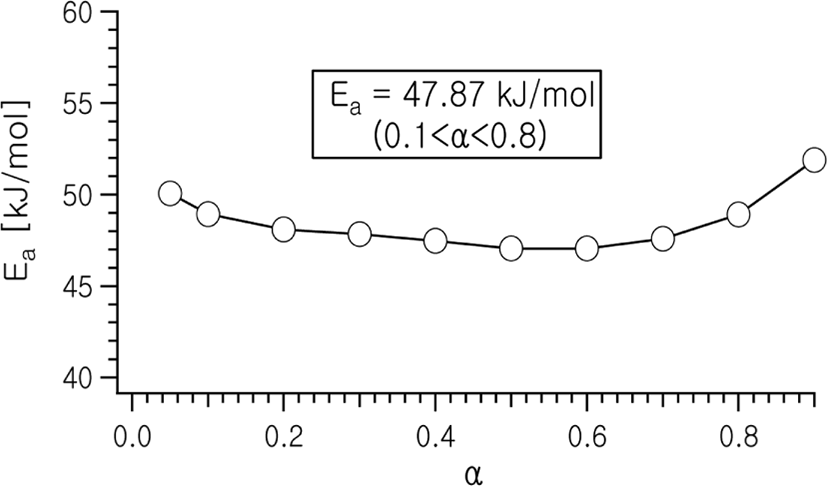
전환율에 따른 활성화 에너지의 변화는 반응 초기에는 승온에 따르는 반응물의 점도 희석 효과로 인하여 약간 감소하다가 α값이 0.1~0.7의 구간에서는 평균 47.9 kJ/mol로서 거의 일정한 값을 나타낸다. 이후에 더 반응이 진행됨에 따라 고분자화에 따른 반응물의 점도증가로 인한 라디칼들의 capping 현상과 확산 곤란으로 인하여 점점 더 값이 커지는 쪽으로 변화해 나가는 것을 볼 수 있다.
한편, 식 (1)에서의 전환율 함수 f(α) 에 관한 수학적인 모델은 반응활성화에너지 값이 일정할 경우, Malek에 의하여 유도된 결과를 이용하여 어떤 모델을 적용할 지를 결정할 수 있다.13 이를 위하여 다음의 식 (4) 및 식 (5)를 정의하는 것이 필요하다.
여기서 x=−Ea/RT 이며, π(x)는 식 (6)에서 표시되는 바와 같은 온도 적분과 관련된 수식이다.14
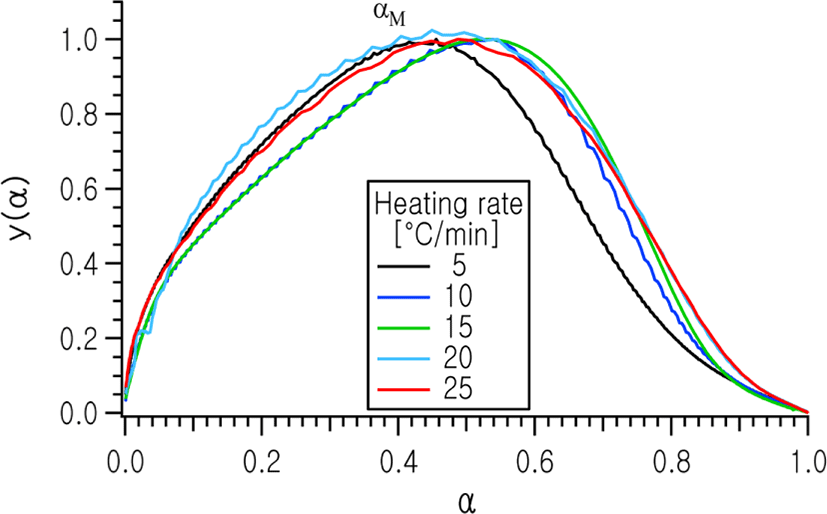
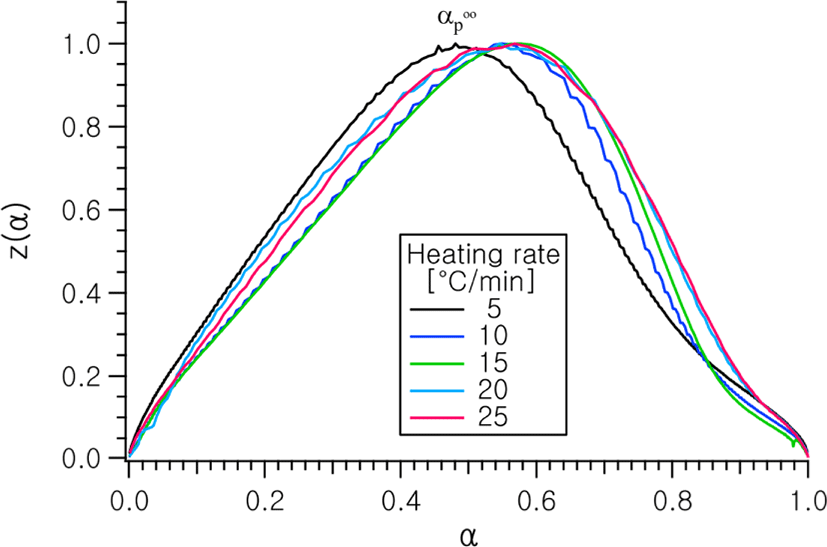
Figure 6 및 7에는 전환율 변화에 따른 y(α) 및 z(α)의 변화 곡선을 각각 나타내었다. 각각 곡선의 피크 점에서의 전환율 αM 및 는 f(α) 모델함수의 특징적인 값을 평가하는 데에 사용된다.13
각각의 승온속도에 대하여 y(α)과 z(α) 곡선으로부터 얻어진 αM과 , 및 DSC 열분석 곡선으로부터 얻어진 피크 점에서의 전환율, αp의 값을 Table 2에 나타내었다. 이로부터 αM의 값이 0 < αM < 이고, < 0.632이므로 전환율 함수 f(α)는 Malek 등의 연구 결과에 따라 다음의 식 (6)과 같이 Sestak-Berggren식으로 표현되는 자동촉매 반응 모델을 적용할 수 있음을 알 수 있다.14,15
| β[°C/min] | αM | αp | |
|---|---|---|---|
| 5 | 0.46 | 0.48 | 0.48 |
| 10 | 0.54 | 0.55 | 0.55 |
| 15 | 0.54 | 0.58 | 0.57 |
| 20 | 0.50 | 0.55 | 0.55 |
| 25 | 0.50 | 0.57 | 0.55 |
| avg. | 0.51 | 0.55 | 0.54 |
한편 αM에서 y(α) 값이 최대가 되므로, 식 (2)와 (4)로부터 유도되는 을 풀면 αM = m/(m+n)의 관계식을 얻을 수 있다. 또한 p=m/n로 정의하면, 식 (7)은 f(α)=[αp(1−α)]n로 쓸 수 있으므로 n값은 plot의 기울기로부터 구할 수 있다. Table 3에는 Sestak-Berggren 자동 촉매 반응 모델을 적용하여 계산된 샘플 시스템의 kinetic parameter들을 나타내었다.
| β [°C/min] | Ea [kJ/mol] | ln A | m | n |
|---|---|---|---|---|
| 5 | 47.9 | 18.26 | 0.55 | 0.64 |
| 10 | 18.90 | 0.82 | 0.70 | |
| 15 | 17.23 | 0.62 | 0.57 | |
| 20 | 19.54 | 0.61 | 0.51 | |
| 25 | 17.07 | 0.52 | 0.54 | |
| avg. | 18.20 | 0.62 | 0.59 |
따라서 이 값들을 이용하면 본 연구에 사용된 비닐에스터 수지 시스템의 반응속도식은 최종적으로 다음의 식 (8)과 같이 표시될 수 있다.
Conclusion
용이한 공정 조절과 에폭시 수지의 우수한 물리화학적 특성을 함께 나타낼 수 있는 비스페놀-A 타입의 비닐에스터 바인더 수지시스템의 경화반응에 대하여 비등온 DSC 열분석법을 이용하여 살펴 보았다. 연구를 통하여 다음의 결과를 얻을 수 있었다.
-
온도변화에 따른 수지시스템의 열변화곡선은 단일 피크의 형태를 가지는 모양으로서 승온속도가 커짐에 따라 열평형에 따른 시간으로 인하여 더 높은 온도 쪽으로 shift하는 모습을 보였다.
-
온도에 따른 전환율의 변화는 Sigmoid curve형태의 전형적인 자동촉매반응의 모습을 나타내었다.
-
FWO 해석법을 이용하여 살펴본 전환율에 따른 반응활성화에너지의 변화는, 반응 초기에는 약간 낮아지는 경향을 보이다가 전환율이 0.1~0.7 구간에서는 47.9 kJ/mol 정도의 거의 일정한 값을 나타내었으며, 그 이후에는 반응물의 점도 증가에 따른 확산저하로 인하여 서서히 증가하는 모습을 나타내었다.
-
반응속도식에 대한 수학적 모델 해석법을 적용하여 본 결과는 전환율 함수 f(α)는 Sestak-Berggren 자동 촉매 반응 모델이 적합한 것으로 나타났으며, 이에 따른 kinetic parameter들을 이용하여 반응속도식을 정량적으로 나타낼 수 있었다.