Introduction
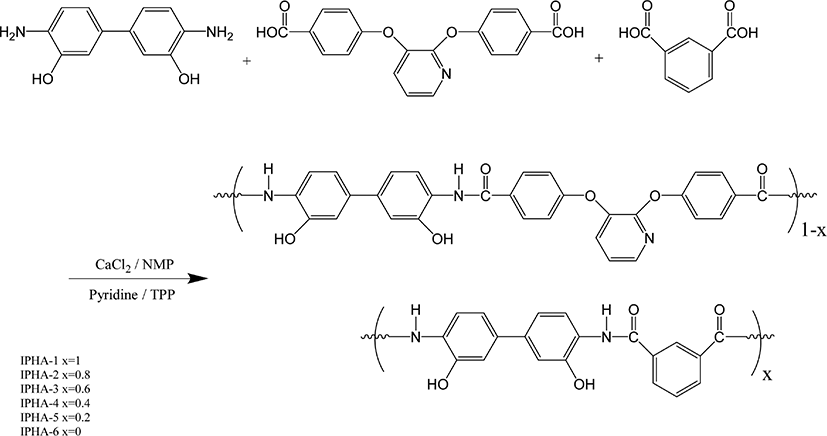
현대 산업 발전과 함께 고분자 재료의 사용은 날로 늘어나고 있다. 이들 재료 중 최근 들어 자동차, 전기 전자, 우주 항공 등 첨단 산업 분야의 발전으로 인하여 우수한 특성을 갖는 고분자 재료의 필요성이 증대되고 있다. 특히 높은 내열성과 난연성, 우수한 내화학성, 내후성 및 기계적 성질을 갖는 소위 고성능 고분자재료가 요구 되고 있는데, polybenzoxazole (PBO), polyimide (PI), polyetheretherketone (PEEK) 및 aromatic polyamide (aramid) 등을 예로 들 수 있다.1,2 이들 재료중 PBO는 헤테로고리 방향족 고분자 중 대표적인 내열성 고분자로 벤젠고리와 헤테로고리가 규칙적인 반복단위로 구성되어 있으며, 또한 이들 사이의 공명구조로 인하여 분자사슬의 강직성을 보인다. PBO 섬유는 1970년대 후반 polybenzthiazole (PBZT) 합성을 미국 공군 연구소에서 처음으로 합성 하면서 시작되었다. 그 이후 1991년 일본의 Toyobo 사와 Dow Chemical 사가 공동으로 PBO 섬유인 Zylon을 처음으로 개발 하였고, 1998년 일본의 Toyobo 사가 단독으로 200톤/년 규모의 Zylon을 생산 하게 되었다. PBO 섬유는 기계적 특성이 우수하여 인장강도는 아라미드의 2배 수준이며 탄성율은 탄소섬유의 성능과 비슷한 슈퍼섬유로 알려져 있으며 현재는 스포츠분야 , microelectronics, 그리고 우주 항공 분야 등에서 폭넓게 응용되고 있다.3-5 PBO는 난연특성 또한 우수한 것으로 알려져 있는데 미 연방 항공우주국(FAA)에서 ASTM E-1354 시험법으로 행한 시험에서 그들의 방염성 목표인 50 KW/m2 의 열흐름에서도 연소 되지 않는 유기고분자로서 가장 우수한 특성을 보였다.6 이처럼 여러 가지로 많은 장점을 갖는 PBO 지만 고분자 구조 자체의 강직성으로 인한 높은 열안정성 때문에 용융되지 않아 열에 의해서 가공하지 못하고 용액 상태에서만 가공한다. 용액 상태의 가공도 아라미드 고분자처럼 일반 유기용매 보다는 황산과 같은 일부 강산에서만 용해되어 가공 상의 많은 어려움이 따른다. 이러한 가공상의 문제점을 해결하기 위해서 polyimide (PI)의 경우에는 PI 전구체인 poly(amic acid) (PAA) 상태에서 가공한 후 열에 의해서 PI로 전환 하는 방법을 선택 하였으며, PBO역시 그의 전구체인 polyhydroxyamide (PHA) 상태에서 가공한 후 열고리화 반응에 의해서 PBO로 전환시켜서 가공시 발생되는 문제를 해결 하고자 하고 있다.7 PHA는 일반 극성 유기용매들에 잘 용해되고 성형성도 좋은 것으로 알려져 있는데, 그 구조들을 보면 다양한 구조를 가지나 대부분 높은 내열성과 기계적 강도를 위해 견고한 구조를 가지는 방향족 polyamide이다. 이 중합체의 용해도를 향상시키기 위해서는 열을 가하거나 혹은 LiCl 과 같은 염을 첨가 하여야 한다. 또한 PBO로 전환을 위한 열 고리화 반응을 위해서는 높은 온도가 필요한데, 예를 들어 3,3′-dihydroxybenzidine 과 isophthaloyl chloride의 중합에 의해서 제조된 PHA는 대략 350°C 이상의 높은 온도에서 일정시간 가열 하여야만 PBO로 열고리화 반응이 일어나기 때문에 그에 따른 에너지 소모 및 고분자 가공상의 여러 문제점들이 야기된다. 이러한 내용들을 해결하기 위해서 고분자 구조 자체를 다양하게 변화 시키는 일들이 그동안 진행 되어왔다.8,9 예로 고분자 주 골격에 ether 혹은 methylene 과 같은 유연한 연결단위 혹은 비선형 단위를 도입 하거나 아니면 주 골격에 벌키한 치환그룹을 도입하여 열고리화 온도를 낮추거나 고분자의 용해도를 향상 시키고자 하는 일들이 진행 되어 왔다. 본 연구팀에서도 PHAs의 내열 특성 및 기계적 물성의 희생을 최소화 하면서 용매 특성을 향상 시키고자, 벌키한 oligo (oxyethylene) 치환기나 quinoxalinedioxy 단위 혹은 pyridinedioxy 같은 비선형단위 등이 도입된 여러 종류의 중합 및 공중합체들을 합성하여 그 특성들을 조사하였는데, 대부분 용해도는 향상된 반면에 중합체들의 기계적 성질 및 열적 성질은 기대보다는 감소되는 결과를 보였다.9,10 따라서 본 연구에서는 지속적인 이러한 연구의 일환으로 중합체의 구조 단위 중 견고한 단위를 부여하는 diacid에는 isophthalic acid 와 유연하며 비선형 단위를 부여하는 4,4′-(2,3-dihydroxypyridine)dibenzoic acid를, diamine으로는 3,3′-dihydroxybenzidine을 다양한 조성의 몰비로 반응시켜 중합체들을 합성하고 그 중합체들의 구조 조성비에 따른 여러 물성들과의 상관관계를 조사하고자 한다.
Experimental
본 연구를 위한 단위체 및 중합체의 합성을 위해서 사용한 2,3-dihydroxypyridine (Santa Cruz Biotechnology, U.S.A)과 3,3′-dihydroxybenzidine (TCI, Japan)은 약품들을 승화 정제하여 사용하였다. 4-fluorobenzonitrile (TCI, Japan)과 triphenyl phosphite (TPP) (Aldrich)는 정제 없이 그대로 사용하였다. CaCl2 (Junsei, Japan)는 24시간 동안 80°C의 진공 건조기에서 건조하여 사용하였으며, N,N′-dimethylformamide (DMF) (Junsei, Japan), N,N′-dimethylacetamide (DMAc) (Junsei, Japan)와 N-methyl-2-pyrrolidone (NMP) (Junsei, Japan)는 건조된 MgSO4를잘 섞은 후에 48시간 동안 저어준 후 감압 증류하여 사용하였다. Toluene과 ethanol은 OCI (Korea)사의 제품을 그대로 사용하였다.
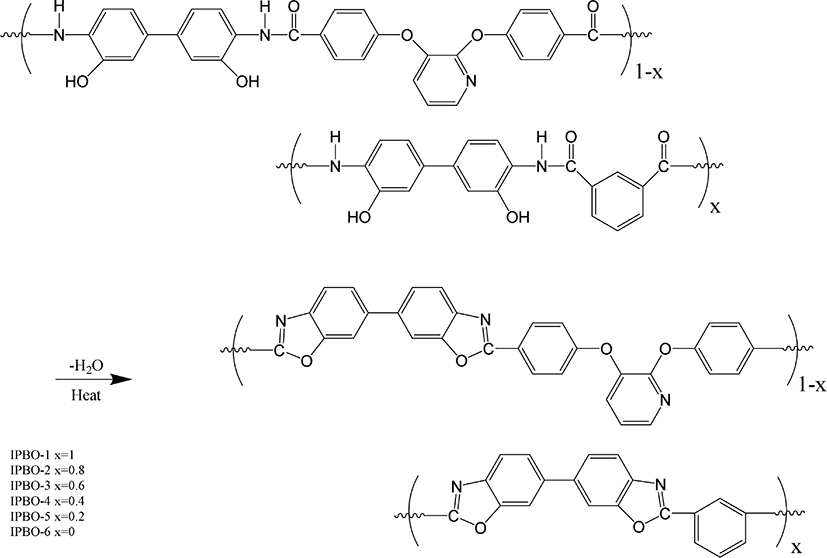
본 연구에서 제조된 4,4′-(2,3-pyridinedioxy)dibenzoic acid 단위체 와 중합체들(PHAs)은 Park 의 방법을 일부 참고하여 수정하여 중합하였다.10 중합체들의 합성 경로는 Scheme 1에 보였다. 또한 열 고리화 반응을 거쳐 제조된 PBOs의 합성경로는 Scheme 2에 보였다. PHAs의 합성은 isophthaloyl 단위를 갖는 diacid 와 pyridinedioxy 단위를 갖는 diacid의 몰 조성 비율을 적절히 변화시켜 중합 및 공중합체를 합성 하였다. 본 연구에서 isophthaloyl 단위와 pyridinedioxy 단위를 갖는 중합체를 각각 IPHA-1 과 IPHA-6라 하였고 isophthaloyl/pyridinedioxy 단위의 조성비가 0.8/0.2, 0.6/0.4, 0.4/0.6, 0.2/0.8인 공중합체의 경우 IPHA-2~IPHA-5로 표기 하였다. 각 중합체들 중 IPHA-4의 제조 방법을 다음과 같이 설명 하였다. Ar 가스로 충전된 3구 반응기에 pyridine 0.15 mL와 NMP 1 mL를 각각 가하고 CaCl20.15 g (1.3514 mmol)을 넣은 다음 반응기 온도를 90°C로 올리고 약 5분간 저어주었다. 잘 용해된 반응 혼합물에 isophthalic acid 0.0461 g (0.2774 mmol)과 4,4′-(2,3-pyridinedioxy)dibenzoic acid 0.1461 g (0.4162 mmol)를 첨가하여 잘 녹인 다음, 3,3′-dihydroxy-benzidine 0.15 g (0.6936 mmol)과 triphenyl phosphite (TPP) 0.5 mL를 가하여 투명하게 녹을 때까지 잘 저어주었다. 반응물 온도를 125°C 로 올린 다음 약 2시간 동안 반응시켜 메탄올에 침전시키고 연 노란색의 중합체를 얻었다. 분리된 중합체는 뜨거운 메탄올 과 증류수로 여러 번 세척하여 불순물 및 저분자량의 고분자들을 제거하였다. 수거된 중합체들은 40°C 의 진공 건조기에서 24시간 동안 건조하였으며 수득률은 94%를 보였다. 합성된 PHAs는 모두 열고리화 반응을 이용하여 PBOs로 전환되었으며 이들 PBOs를 IPBO-1~IPBO-6로 각각 표기하였다.
본 연구에서 합성된 단위체 및 PHAs는 FT-IR spectrometer (8601PC, Shimadzu. Co.)와 1H-NMR spectrometer (JNM-LA300, JEOL. Co.)를 사용하여 각 화합물들의 특성 밴드 및 chemical shifts을 통해서 합성을 확인하였다. 중합체들의 열적성질 조사는 DSC (DSC 2010, TA)를 이용해서 가열속도 10°C/min로 질소 분위기 하에서 50~450°C 온도범위까지 측정하였다. 이때 열고리화 거동과 관련된 흡열피크와 함께, 유리전이온도 유무도 확인하였다. 또한 TGA (TGA 2050. TA)을 사용하여 공기 와 질소분위기하에서 가열속도 10°C/min로 50~900°C까지 측정하여 열고리화 거동 및 열 안정성을 조사하였다. PHAs 와 PBOs들의 X-선 회절곡선들을 관찰하기 위해서 Xper Pro 회절분석기(PANalytical. Co)를 사용하였으며 2.5~50° (2θ)의 범위를 스캔하여 PHAs 와 PBOs를 관찰하였다.
Results and Discussion
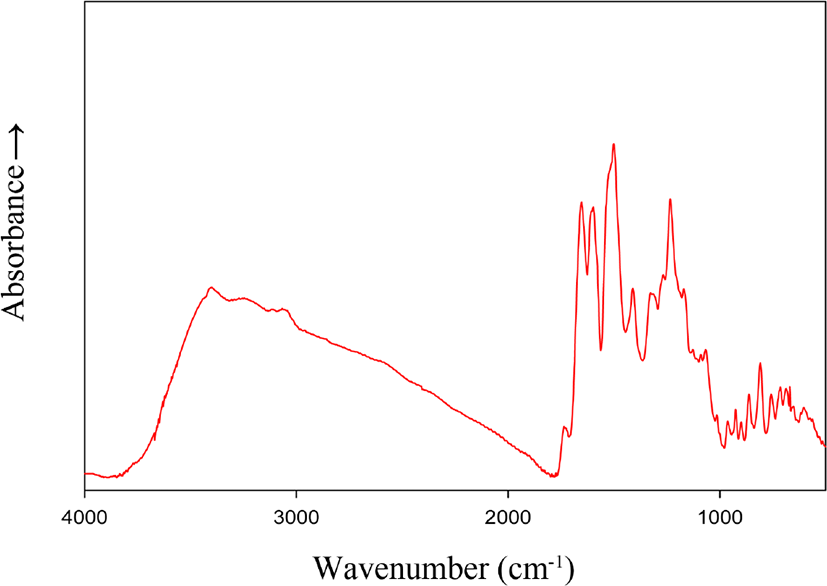
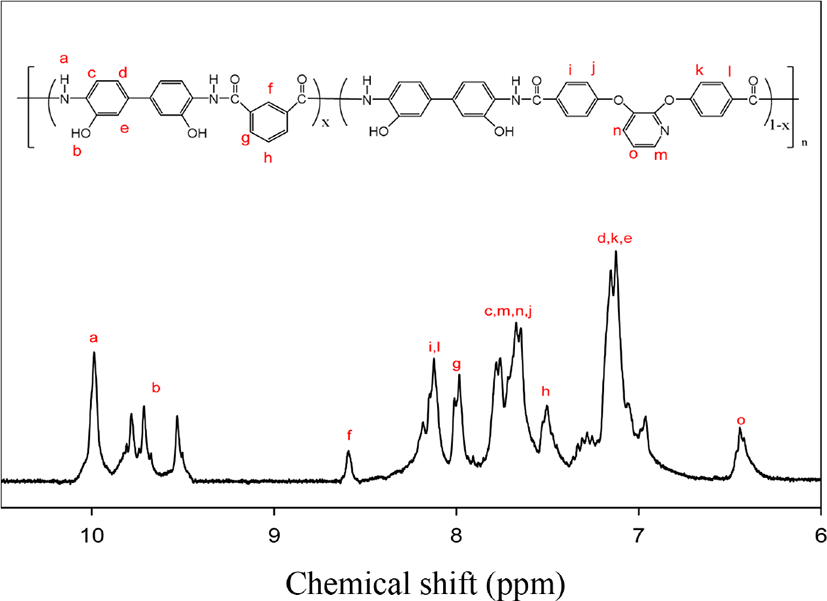
본 연구에서 합성된 단량체 및 중합체들은 FT-IR과 1H-NMR을 통하여 화합물들의 합성 여부를 확인하였다. Figure 1과 2에 본 연구에서 합성된 중합체들 중 IPHA-4의 FT-IR 과 1H-NMR 스펙트럼을 각각 표본으로 보였다. 먼저 FT-IR 스팩트럼을 보면 폴리아마이드의 합성이 되었음을 가장 대표적으로 보여주는 아마이드 결합의 C=O stretching에 해당하는 흡수밴드를 1655 cm− 에서보여 주었고, O-H stretching 흡수밴드에 해당 하는 브로드한 피크를 3000~3600 cm− 에서 보여 주었다. 또한 방향족 C=C stretching에 해당하는 1597 cm− 의 흡수밴드와 C-O-C stretching에 해당하는 흡수 밴드를 1233 cm− 에서 확인함에 따라 중합체가 합성되었음을 확인하였다. 1H-NMR 스펙트럼에서는 6.3~6.5 ppm에서 pyridine 고리 5번 수소의 chemical shift를, 6.4~7.4 ppm에서 바이페닐렌 단위와 pyridine 고리의 chemical shift를 중첩해서 보여 주었으며, 7.4~7.6, 7.9~8.0과 8.1~8. ppm에서는 isophthaloyl 단위의 chemical shift를 보여 주었다. 또한 7.6~7.9 ppm에서 pyridine 고리와 페닐렌 단위의 chemical shift가 중첩되었고, 8.1~8.3 ppm은 페닐렌 단위의 chemical shift를, 9.4~9.9 ppm은 하이드록시기의 수소 chemical shift를 9.9~10.2 ppm은 아마이드 결합의 수소 chemical shift를 보여 주었다. 이처럼 각 프로톤들에 해당되는 피크들을 확인 하였으며, 아울러 각 피크들의 면적 비를 확인 한 결과 이론값과 일치함에 따라 이 공중합체가 합성되었음을 확인하였다.
PHAs의 inherent viscosity 와 만들어진 film quality 에 대한 내용들을 Table 1에 보였다. 점도 측정 실험에서 용매는 DMAc를 사용하였고, 용액의 농도는 0.1 g/dL로 하여 용해되지 않는 불순물들을 제거하고 35°C의 항온베스에서 측정하였다. inherent viscosity 값들은 0.31~0.59 dL/g 범위의 값들을 보였다. 중합체들의 필름형성 여부를 확인하기 위해서 다음과 같이 시험하였다. DMAc/LiCl 혹은 DMAc 3 mL 에 PHAs 1 g을 용해시키고 불순물들을 제거한 다음 필름 제조기구(10 × 10 cm)에 수회 도포 후 60°C 건조 건조기에서 3 시간 이상 건조 시켰는데, 중합체들에 따라서 건조 시간을 약간씩 달리 하였다. 기구에서 분리된 필름들은 증류수와 에탄올에서 수 시간 방치 한 다음 Table 1에서 보여준 상태의 필름들을 얻었다. 중합체들 대부분 모두 비교적 양호하게 필름이 제조되었으며, 필름의 색깔들은 IPHA-1에서 IPHA-6으로 갈수록 짙은 갈색에서 옅은 갈색으로 변화됨을 보였다. 또한 IPHA-1의 경우 약간 brittle 한 성질을 보였고 PHA-2와 3의 경우는 IPHA-1보다는 덜 brittle 하였으며 나머지 중합체들은 비교적 유연한 필름 상태를 보여 주었다. 본 연구에서는 중합체들의 필름 제조 여부와 상태만 확인하였고, 중합체들의 기계적 특성 및 난연특성들을 조사하기 위해서는 더 큰 사이즈의 필름들이 필요하며 차기 논문에 이들에 관한 연구 결과를 발표하기로 하겠다.
| PHAs | ηinh (dL/g) | Film Quality |
|---|---|---|
| PHAs | ||
| IPHA-1 | 0.59 | Brittle |
| IPHA-2 | 0.38 | slightly Brittle |
| IPHA-3 | 0.33 | slightly Brittle |
| IPHA-4 | 0.36 | Flexible |
| IPHA-5 | 0.31 | Flexible |
| IPHA-6 | 0.55 | Flexible |
Table 2에는 제조된 PHAs 와 PBOs의 용해도를 각종 용매들을 사용하여 조사한 결과들을 정리하였다. IPHA-1의 경우 DMF, DMSO, NMP 및 DMAc에 LiCl을 첨가하여야만 용해되는 특성을 보였다. 이러한 결과는 비록 중합체가 PHA라 하더라도 중합체 골격 자체가 isophthaloyl 단위로 이루어진 견고한 구조로 인하여 LiCl 과 같은 염을 첨가하여 용매의 극성을 높여야 용해되는 특성을 보였다. 백등의 연구에서도 이와 같은 결과를 보고한 바 있다.11 Pyridine의 경우는 모든 중합체들이 부분적으로 용해되는 특성을 보였다. 이는 전자의 용매들보다는 극성이 낮기 때문으로 생각된다. 반면에 IPHA-6의 경우는 pyridine 과 THF를 제외하고 모두 실온에서 용해되는 특성을 보였으나, TFA 경우에는 IPHA-4, 5와 6은 실온에서 잘 용해되었으나 IPHA-1, 2와 3은 부분적으로 용해되는 특성을 보였다. 황산의 경우는 예상한 바와 같이 모든 PHAs이 실온에서 잘 용해됨을 보였는데 시간이 지날수록 짙은 갈색으로 산화되는 현상을 관찰 할 수 있었다. 앞에서 언급된 단독 중합체들과는 달리 공중합체인 IPHA-2의 경우를 보면 실온에서 모든 aprotic 용매에서 잘 용해됨을 보였다. 이는 주 골격에 비 선형단위 이면서 극성인 pyridine 고리와 유연한 에터 단위가 도입된 pyridinedioxy 단위가 전체 공중합체 조성비 중 가장 적은 비율인 0.2 만 포함 되었음에도 용해도가 향상됨을 보이는 것은, pyridinedioxy 단위가 용매특성 향상에 매우 효율적임을 보여주는 것이라 하겠다. 이러한 결과는 TFA에서도 추가로 입증해 보여주는데 전체 공중합체 조성비 중 pyridinedioxy 단위의 조성비가 0.6으로 향상되자 그 전 조성(IPHA-4)에서는 부분적으로 용해되었던 공중합체가 실온에서도 잘 용해됨을 보여주었다.
PBOs의 용해도를 측정하기 위해서 먼저 PHAs을 열처리 하였다. 열처리 온도는 DSC 상에서 흡열 피크가 끝나는 온도에서 약 2분간 등온에서 유지한 다음 용해도 실험에 임하였다. PBOs은 대부분의 연구 결과에서 보고된 바와 같이 일반 유기 용매에는 거의 용해되지 않고, 진한 황산에서만 부분적으로 용해되거나 혹은 가열상태에서 완전히 용해되는 특성을 보인다. 이러한 이유는 PBO의 강직한 구조와 함께 열고리화 반응을 위해서 대부분 350°C 이상의 고온에서 열처리하는 과정에서 발생하는 라디칼들에 의한 가교결합 때문으로 생각된다.12 본 연구의 결과에서도 황산에만 모든 조성의 중합체들이 부분적으로 용해되는 특성을 보였다. 그러나 aprotic 용매 중 NMP의 경우에만 LiCl 과 함께 가열 하였을 경우 IPHA-4,5와 6이 부분적으로 용해되는 특성을 보였는데, 이들 3 중합체 중 pyridinedioxy 단위의 조성비가 증가 할수록 용해도가 향상됨을 보였다.
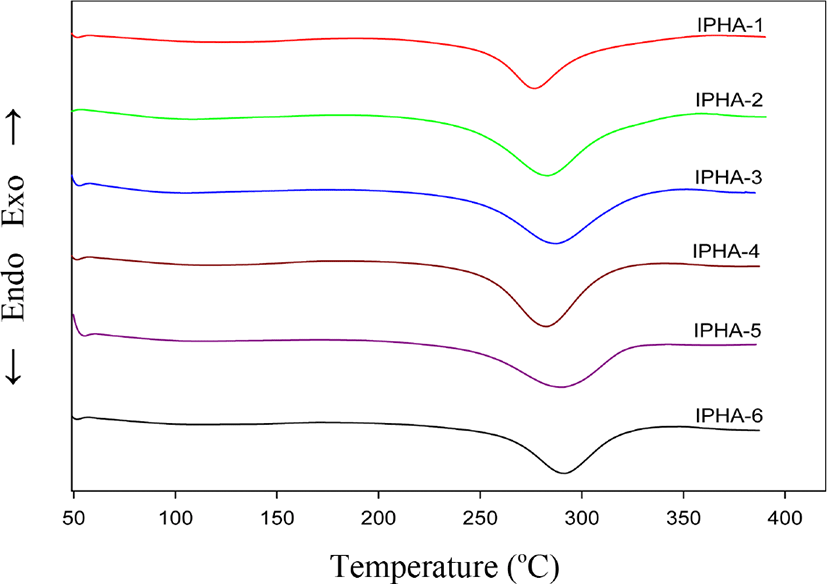
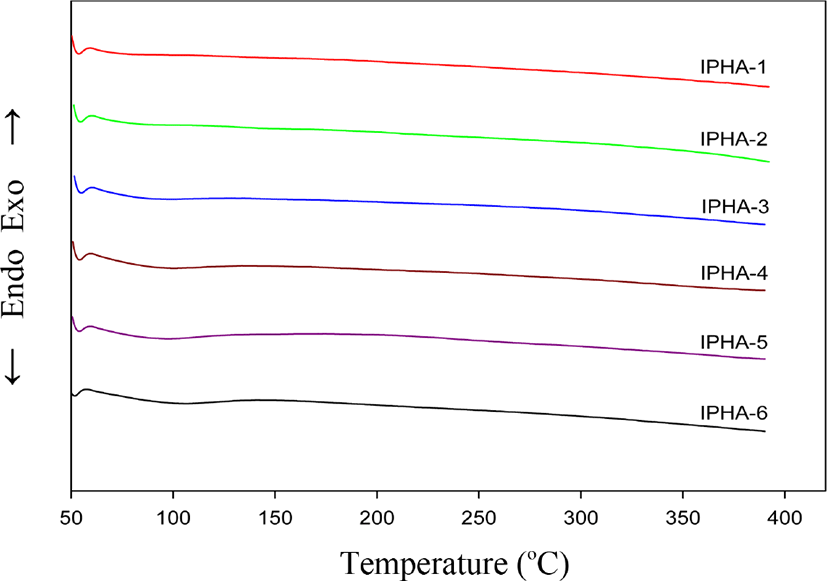
Figure 3과 Table 3은 PHAs의 DSC 1차 열 곡선들과 그 결과들을 보였다. DSC 열 곡선들은 277~291°C 범위에서 흡열피크들이 형성되었음을 보여 주었다. 이 온도 영역은 PHAs의 hydroxy 그룹이 아마이드 결합의 카보닐기를 친핵성 공격하여 부산물인 물이 방출되고 oxazole 고리가 형성되는 소위 열고리화 반응으로 인하여 PBOs로 전환 되는 온도 영역이다. 만일 본 연구처럼 PHAs를 합성 한 후 열에 의해서 PBOs 로 가공된다면 이온도 영역은 에너지 차원에서 매우 중요한 요소가 된다. 일반적으로 PHA의 열처리 온도는 대략 350°C 이상이며 어떤 경우는 400°C 이상의 고온이 필요하다. 다시 말해 전환 온도가 낮을수록 에너지 절약차원에서 유리하다. 이러한 문제점과 관련하여 여러 연구자들이 유연 혹은 벌키한 그룹을 주 골격에 도입하여 합성한 결과 중합체의 용해도와 함께 전환온도가 낮아짐을 보고한 바 있다.13-15 본 연구팀에서도위와 유사하게 시도하였고 그 결과 용해도 향상과 함께 전환온도는 낮아지는 결과는 얻었지만 반면에 중합체의 열안정성이 매우 낮아지는 결과를 얻었다.16 본 연구에서의 열고리화 피크 온도를 보면 IPHA-1이 277°C 이고 IPHA-6은 292°C를 보였다. 이 두 중합체들을 비교하면 전자가 후자보다 중합체의 구조적인 특성상 더 견고해 보이지만 온도는 15°C 정도 낮아짐을 보였다. 나머지 공중합체들의 열고리화 온도들을 비교해 보면 283°C 에서 290°C 로 pyridinedioxy 단위의 농도가 증가 할수록 고리화 온도가 증가하는 경향성을 보여 주었다. 이러한 결과로 보면 열고리화 온도가 중합체 골격의 강성에 의존하기 보다는 중합체 구조의 길이에 의존 하는 것으로 보이지만 좀 더 구체적이고 체계적인 연구가 필요하다. 엔탈피변화 값(ΔH)은 116-189 J/g의 범위를 보였다. 공중합체들은 pyridinedioxy 단위의 농도가 증가함에 따라서 엔탈피변화 값이 감소되는 현상을 보여 주었지만, 중합체 전체적인 엔탈피변화 값과 중합체들의 열고리화 온도와의 관계에서 어떠한 경향성도 보이지 않는 것으로 생각된다.
본 연구에서 열고리화 반응 이후 PHAs 가 PBOs로 전환된 것을 확인하기 위해서 FT-IR 분석을 통해서 확인하였다. DSC 상에서 열처리 한 후 열처리 전과 후의 FT-IR 스펙트라를 Figure 4에 보였다. 3000~3500 cm− 에서 –OH 와 -NH stretching 흡수 피크와 1655 cm− 에서 amide 결합의 C=O stretching 흡수 피크를 보였는데, 열고리화 반응 이후에는 언급한 피크들이 사라지고 1544, 1461, 1305 및 1052 cm− 에서 oxazole 고리의 특성 흡수 피크인 C-N 과 C-O 에 관련된 흡수 피크들을 확인함으로써 모두 PBO 로 전환되었음을 확인하였다.
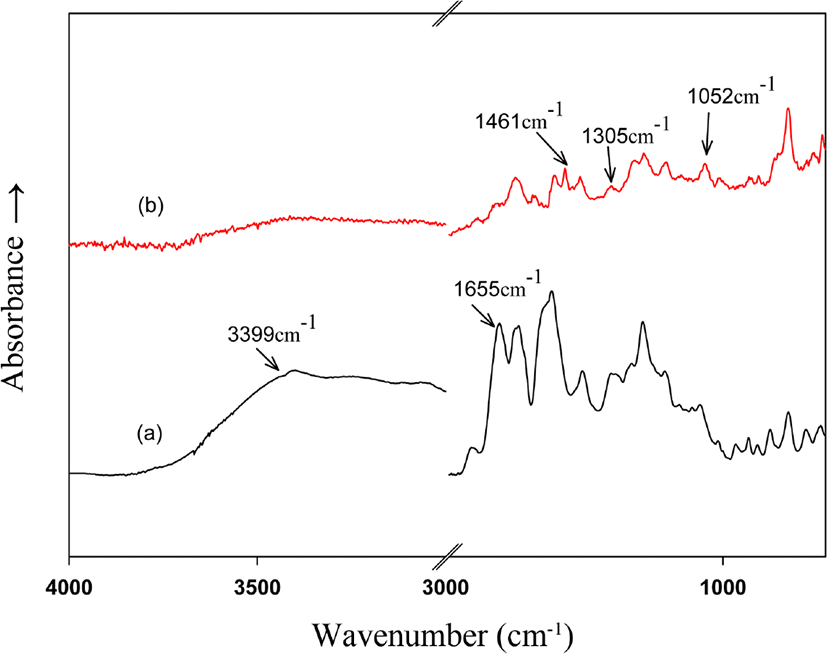
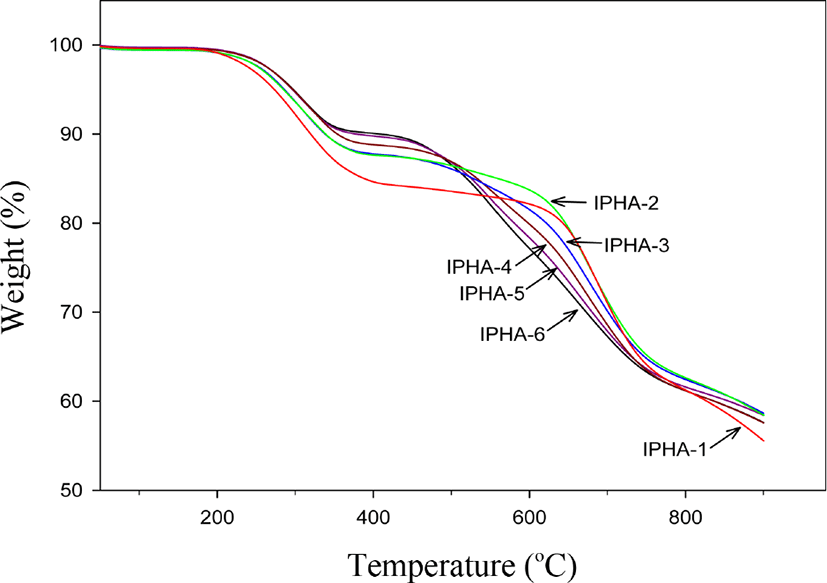
Figure 5 와 Table 3에 PHAs의 TGA 열분해 곡선과 이들에 대한 결과를 보였다. Figure 4 열 곡선에서 보인 바와 같이 모든 중합체 및 공중합체들이 뚜렷한 두 단계의 열 분해곡선을 보여 주었다. 첫 번째 분해 단계는 대략 200~375°C 까지 범위로, 열고리화 반응에 의해서 물이 빠져 나가는 단계를 보여 주는 것으로 앞에서 설명 하였던 DSC 열 곡선의 열고리화 반응온도 범위와 대략 일치한다. 열고리화 반응시 물이 제거되는 이론값들을 계산해 보면 중합체 전체적으로 6.6~10.3% 이고 실제 물 제거율들은 대략 9.4~13%로 대략 2~3% 정도 더 많은 양이 제거 된 것으로 보이는데 이는 중합체 합성 후 세척 과정에서 제거되지 못한 용매 혹은 다른 불순물 때문으로 생각 된다. 두 번째 분해 단계는 대략 450~600°C 범위를 보여주었는데 PHAs가 PBOs로 전환된 이후 열분해가 되는 구간을 의미한다. 이 구간의 열분해 곡선 패턴을 보면 IPHA-1의 경우 열고리화 반응 이후 어느 정도 안정을 유지하다가 650°C 이후 급격히 분해되는 양상을 보였으며, IPHA-6의 경우는 열고리화 반응 이후 약 500°C 이후 IPHA-1 과 비교해 상대적으로 완만히 분해되는 양상을 보였다. 이러한 현상은 char 수득률과 밀접한 관계를 갖는다. 분해온도는 전자가 후자보다 약 200°C 정도 높음을 보였는데 이는 중합체 구조의 강직성에 기인되는 것으로 생각된다. Table 3에 보인 Td,max 값들은 TGA 실험을 통한 DTG 곡선에서 얻은 값들인데 대략 669~689°C 를 보였다. 이는 열분해 곡선 중에서 무게손실이 최대인 온도를 의미하는 것으로 높은 내열성과 난연 특성을 갖는 고분자들은 이들 중합체 와 같이 높은 값을 보인다.17 공중합체들은 이들 온도에 대해서 isophthaloyl 단위 조성비 증가와 함께 약간 증가하는 경향성을 보였다. 900°C 에서 55.9~ 59.2%의 비교적 높은 char 수득률(잔유량)을 보였다. Char는 외부에서 가해지는 열이나 산소를 차단하여 고분자 재료 내부를 보호하고 안에서 생긴 휘발성 물질의 방출속도를 느리게 함으로써 고분자 재료의 내열성 혹은 난연성을 향상 시키는데 중요한 역할을 한다.18 따라서 이 들 값들은 재료의 난연 특성과 밀접한 관계를 갖는데, TGA 특성상 수 mg의 샘플로 측정하기 때문에 이들 값들과 난연 특성을 직접적으로 관계 짓는 것은 무리가 있다.
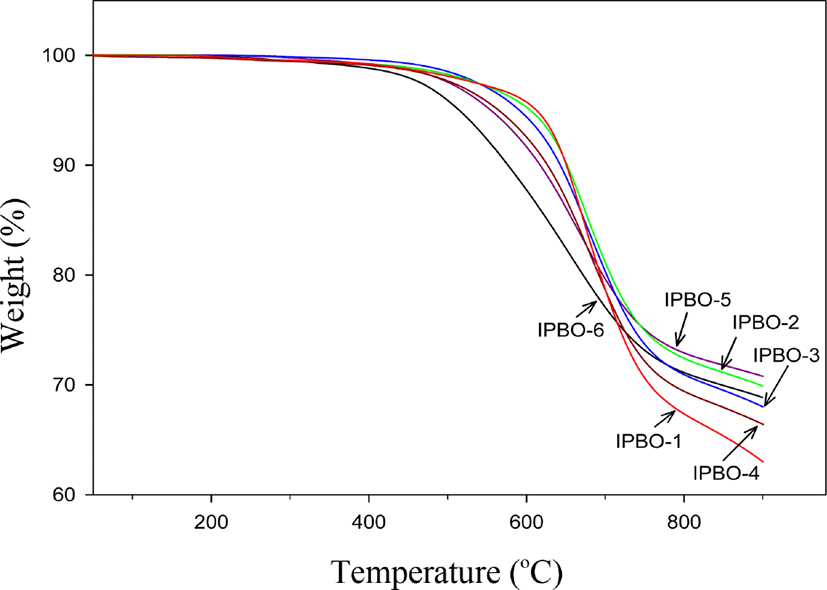
Figure 6 과 Table 3에 PBOs의 TGA 열분해곡선 과 관련된 결과들을 나타내었다. Figure 5처럼 2단계가 아닌 1단계의 분해 곡선을 보였다. 대략 450~500°C 에서 분해가 서서히 시작되다가 약 550~ 650°C 근처 이후 온도에서 분해가 급격히 진행 되는 것을 볼 수 있다. 1단계 분해 곡선만 보이는 이유는 DSC 와 TGA 분석 결과들을 토대로 해서 각 중합체(PHAs)들을 열처리 하여 PBOs로 전환하였기 때문이다. 10% 무게손실 온도를 보면 IPBO-6이 576°C 를 보이고 IPBO-1은 651°C 를 보였다. 공중합체들은 isophthaloyl 단위 조성비 증가와 함께 617, 627, 642 및 652°C 로 크게 증가함을 보였는데, 이는 중합체를 이루는 구조 단위인 isophthaloyl 단위와 pyridinedioxy 단위의 강직성 차이 때문으로 생각 된다. 또한 이들 값들이 PHAs의 10% 무게손실 값들과 큰 차이를 보이는 이유는, PHAs 에서는 10% 무게손실 온도 부근에서 열고리화 반응에 의한 물의 손실 량과 기타 불순물 내지는 일부 PHAs의 열분해에 의한 무게손실이 겹쳐 낮은 온도를 보이는 것으로 순수한 10% 무게손실 온도를 체크하기가 쉽지 않기 때문이다. PBOs의 최대 무게손실 온도는 654~680°C 의 범위를 보였는데, isophthaloyl 단위 조성비 증가와 함께 온도가 증가하는 경향성을 보여 주었다. 단지 PHAs 값들(669~689°C )과 비교하면 약간의 차이를 보이는데, PHAs 의 경우는 TGA 분석 시 중합체에 잔류할 수 있는 용매 혹은 불순물들에 의해서 중합체의 열분해를 촉진 시키는 등 열안정성에 영향을 미칠 수 있는데 반하여 PBOs 의 경우는 사전에 열처리과정에서 용매 혹은 불순물들이 제거되기 때문에 이러한 요인들에 의해서 영향을 받을 확률은 낮아진다. 따라서 PBOs 의 최대 무게손실온도가 신뢰성 면에서 더 높다고 할 수 있다. 900°C 에서의 char 수득률을 보면 63.0~70.8%의 범위를 보였다. 10% 무게손실 온도나 최대 무게손실 온도와는 정 반대로 char 수득률은 pyridinedioxy 단위 조성비 증가와 함께 증가하는 경향성을 보였다. IPBO-1 과 IPBO-6 단독 중합체들을 비교하면 전자는 63.0% 이고 후자는 68.8%로 후자가 더 높은 이유는 중합체의 구조상 방향족 고리의 증가 때문으로 생각 된다. 일반적으로 방향족 고리는 char 형성에 도움을 주며 또한 중합체 단위에 존재하는 헤테로 고리인 pyridine 고리는 일반 방향족 고리보다는 산화에 의한 분해에 대해 더 안정적으로 char 형성에 더 효과적이었던 것으로 생각된다.19
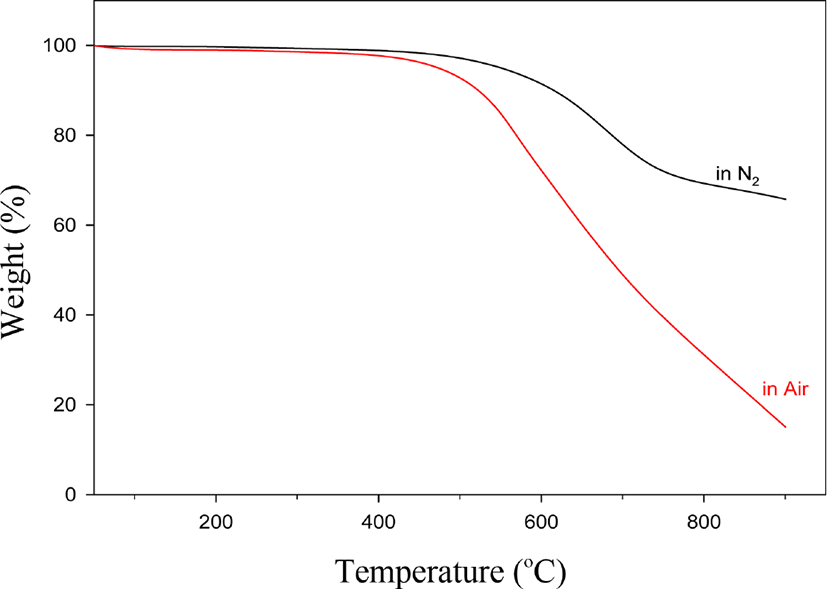
Figure 7에는 IPBO-5의 질소와 공기 중에서 얻은 TGA 열곡선을 보였다. 두 중합체들의 열 곡선을 비교하면 약 450°C 까지는 두 중합체가 비슷한 양상의 분해곡선을 보여주다가 500°C 이후부터 크게 다른 분해 패턴을 보여 주었다. 즉 500°C 이후부터 공기상태에서 측정된 열분해 곡선이 급격히 분해되는 현상을 보여 주어, 900°C 에서 측정된 char 수득률은 29%로 질소분위기에서 측정된 중합체보다 42% 정도 낮음을 보였다. 이러한 결과는 고분자 재료들이 열 분해될 때 공기 중 산소의 영향을 500°C 이전보다는 이후에 심각하게 영향을 받음을 알 수 있고, 아울러 char의 형성에도 영향을 미침을 알 수 있다.17
Figure 8에는 PBOs의 DSC 열 곡선을 보였다. PHAs의 열 곡선을 참고하여 각 PHAs을 열처리 한 후 DSC 열 곡선을 얻었다. 이들을 보면 PHAs의 열고리화 반응에 의해서 기인된 흡열 피크를 전혀 보여 주지 않음 으로써 완전히 PBOs로 전환되었음을 확인 하였다. 또한 열곡선상에서 PBOs의 유리전이온도 존재 여부를 관찰 하였으나 발견하지 못 하였다.
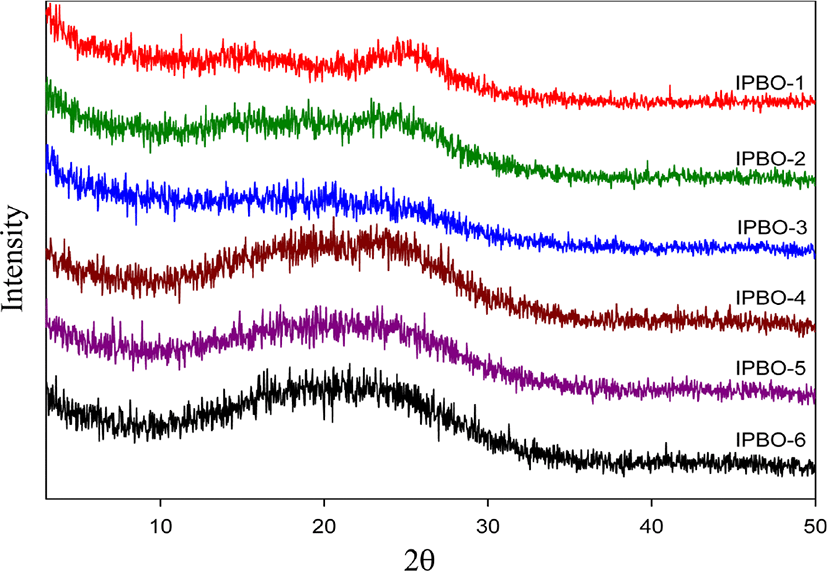
Figure 9 와 10에는 PHAs 와 PBOs의 X-ray 회절 곡선들을 보였다. 각 중합체들의 결정성 여부에 대한 회절 패턴을 분석해 보고자 X-ray 회절 분석기를 이용하여 2θ 2.5~50° 까지 스캔하여 조사하였다. PHA공중합체들의 경우 전반적으로 대략 11.2° 에서 34° 까지 비교적 넓은 halo 타입의 회절 곡선을 보여 주었다. 이는 전형적인 강직한 구조를 갖는 무정형 타입 고분자들의 X-ray 회절곡선들이다.20 IPHA-1의 경우는 다른 PHAs 와 다르게 약간의 결정패턴처럼 보이는 불규칙적인 회절 패턴을 보이는데 이는 isophthaloyl 단위의 강직한 구조에 근거된 중합체 구조 때문이라 생각된다. 그러나 IPHA-2의 경우는 좀 더 부드러운 halo 타입의 회절 패턴을 보여 주었는데, 중합체 주 골격에 비선형 이면서 유연한 그룹으로 이루어진 pyridinedioxy 단위의 첨가로 인한 결과라 하겠다. 이는 용해도 조사와 필름 특성과도 관련성이 있는데 다른 중합체 와 달리 IPHA-1은 LiCl을 첨가해야만 용해되는 특성을 보였고 제조된 필름도 약간 brittle하였다. 그러나 IPHA-2의 경우는 모든 극성 용매에 잘 용해되었고 필름 또한 brittle 하였으나 IPHA-1 보다는 유연하였다. 이처럼 고분자들의 결정성 여부는 용해도 특성뿐만 아니라 필름제조에도 영향을 미친다. Figure 10에 PBOs의 X-ray 회절 곡선을 보였다. PHAs처럼 2.5~50° 까지 스캔하여 조사된 회절 곡선들은 8.7~34° 까지 넓은 halo 타입의 PHAs와 유사한 회절 패턴을 보여 주었다. PHAs 의 회절 곡선들에 비교해서 intensity 면에서 약간 약한 패턴을 보였고 일부 공중합체들은 약간 소각쪽으로 이동하는 양상을 보였는데 이는 PHAs에서 PBOs로의 중합체 구조변화에 따른 결과라 생각된다.
Conclusions
본 연구에서 diamine 으로는 3,3′-dihydroxybenzidine을 diacid로는 isophthalic acid 와 4,4′-(2,3-dihydroxypyridine)dibenzoic acid를 직접축합중합 방법으로 각 조성별로 일련의 PHAs와 PBOs를 제조하고 그 특성들을 조사한 결과는 다음과 같다.
제조된 PHAs의 inherent viscosity 범위는 0.31~0.59를 보였고, isophthaloyl 단위의 조성이 증가 할수록 brittle한 필름이, pyridinedioxy 단위의 조성이 증가 할수록 유연한 필름이 제조되었다. 모든 PHAs의 경우 DMAc등 극성용매에 실온에서 잘 용해되었으나, IPHA-1의 경우에는 LiCl을 첨가하여야 용해되었다. TFA의 경우는 pyridinedioxy 단위의 조성이 0.6 이상인 중합체들만 용해되는 등 중합체 전반적으로 PHAs의 용해도는 pyridinedioxy 단위의 조성이 증가할수록 향상 되는 경향을 보였다. PBOs의 경우는 전 중합체들이 진한 황산에 부분적으로 용해되었고, 극성 용매 중 NMP에서만 LiCl과 함께 가열하였을 때 IPBO-4, 5 와 6이 부분적으로 용해되는 특성을 보였다. PHAs의 열고리화 반응에 의한 DSC 상의 흡열 피크는 isophthaloyl 단위의 조성이 증가 할수록 292°C 에서 277°C 로 감소되는 경향을 보였다. PBOs의 최대 중량 손실온도는 654~680°C 의 범위를 보였고, char 수득률은 63.0~70.8%의 매우 높은 수득률을 보였으며, pyridinedioxy 단위의 조성에 따라서 증가되는 경향성을 보였다. PHAs 와 PBOs의 X-ray 회절곡선 조사에 의하면 halo 타입의 무정형 회절 곡선을 보였다.