Introduction
Poly(ethylene-co-vinyl acetate) (EVA)는 에틸렌과 비닐 아세테이트(VA)의 공중합체이다. EVA의 가교는 과산화물 (peroxide), 전자 빔, 실란 화합물 등을 이용하여 이루어지는데, 과산화물 가교가 가장 널리 사용되고 있다.1-7 가교에 사용하는 과산화물에는 dicumyl peroxide (DCP), perbutyl peroxide, dibenzyl peroxide, 2,5-bis(tert-butylperoxyl)-2,5-dimethylhexane 등이 있으며, 이 중 DCP가 EVA 가교에 주로 사용된다.1-3 가교제 이외에 공가교제(curing coagent)를 함께 사용하여 특성을 향상시킨다. 주로 사용하는 공가교제는 trially cyanurate (TAC)이며, 그 외에 trimethylolpropane triacrylate (TMPTA), trimethylolpropane trimethacrylate (TMPTMA), triallyl isocyanurate (TAIC) 등이 있다.8-10
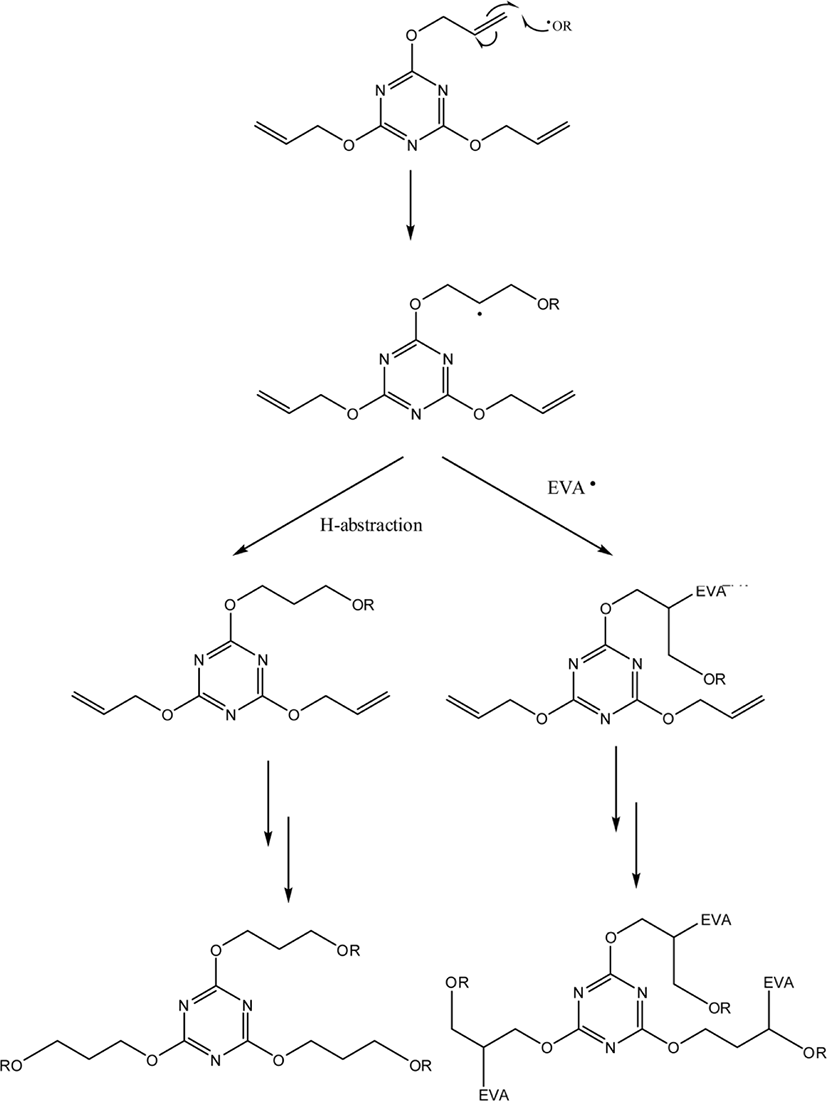
DCP에 의한 EVA의 가교 과정은 DCP의 분해로 생성된 cumyl oxide 라디칼이 EVA 사슬에서 수소를 빼앗아 EVA 라디칼을 형성하는 것으로 시작된다(Scheme 1).11 EVA 사슬의 에틸렌 단위와 VA 단위에서 라디칼이 만들어질 수 있다. 이 때, 에틸렌 단위에 생성된 2개의 EVA 라디칼이 가교결합을 형성할 수 있으며, VA 단위에 생성된 EVA 라디칼 2개가 만나 가교결합을 할 가능성도 있다. 뿐만 아니라 에틸렌 단위에 존재하는 라디칼과 VA 단위에 존재하는 라디칼이 만나 가교결합이 이루어질 수도 있다.
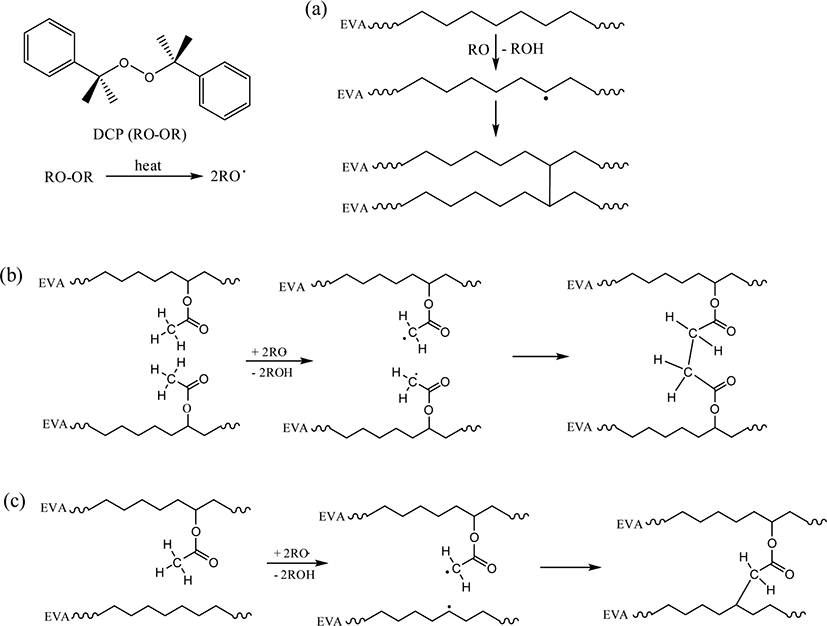
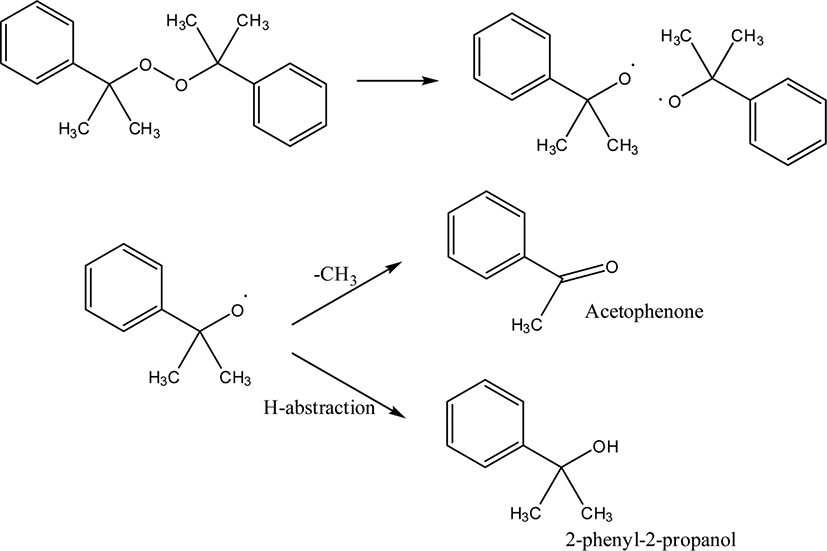
DCP는 Scheme 2와 같이 분해되어 라디칼을 형성한다.12 이 라디칼은 메틸기가 떨어지면서 재배열이 일어나 아세토페논(acetophenone)을 형성한다. 혹은 주변의 수소를 취하여 2-페닐-2-프로판올(2-phenyl-2-propanol)이 형성될 수 있다. Loan은 IR 분광법을 이용하여 DCP의 분해 생성물인 아세토페논과 2-페닐-2-프로판올을 분석하였다.13 아세토페논은 1730 cm−1, 2-페닐-2-프로판올은 3520 cm−1에서 IR 흡수를 나타낸다. Mlejnek은 DCP가 포함된 폴리에틸렌을 GC를 사용하여 분석하였으며, DCP의 분해 생성물로 메탄, 아세토페논, 2-페닐-2-프로판올이 검출되었음을 보고하였다.14
TAC와 같은 공가교제를 사용하면 가교 효율이 향상된다.15 가교 효율과는 별도로 과산화물 가교에서 공가교제는 가교의 분자 구조에 영향을 줄 수 있다. 가교 반응 동안 공가교제를 중심으로 가교를 형성할 수 있다. 공가교제를 첨가하면 가교시간이 단축되고, 오일 등에 대한 내성이 향상된다.16 또한, 과산화물의 효율이 높아지고, 유연성, 인장강도와 경도가 증가한다.
본 연구에서는 EVA의 배합물과 가교물에서 가교제와 그 반응 생성물을 분석하였다. 분석 결과를 바탕으로 가교 반응을 설명하였으며 TAC에 의한 반응도 제안하였다. 가교제로 스테아린산(stearic acid), 산화아연, DCP와 TAC를 사용하였다. 이때 TAC의 유무에 따른 비교를 위하여 DCP만을 사용한 EVA와 DCP와 TAC를 함께 사용한 EVA의 배합물과 가교물을 준비하였으며, 용매로 잔류 유기물을 추출하여 GC/MS로 분석하였다.
Experimental
EVA는 한화케미컬의 EVA 1317 (VA 22 wt%)를 사용하였다. DCP만을 사용한 배합물(HD)과 DCP와 TAC를 모두 사용한 배합물(HDT)을 제조하여 실험하였다. 가교제 함량은 DCP 0.6 phr, TAC 0.5 phr, 스테아린산 1.0 phr, 산화아연 5.0 phr이다.
EVA 배합물과 가교물에서 유기물을 추출하기 위해서 Agilent 사의 2 mL crimp vial을 이용하였다. 추출용매는 Merck 사의 아세톤(acetone)을 사용하였다. 50 mg의 시험편을 1 mm 이하의 크기로 잘라 vial에 넣은 후 아세톤 1.0 mL를 추가하였다. 그 후 crimper를 사용하여 vial과 cap을 고정시켰다. 준비된 vial은 대류식 오븐에 넣어 50°C에서 4 시간 동안 추출하였다. 오븐에서 꺼낸 시료는 상온으로 식힌 후 불순물을 거르고 GC/MS 분석을 진행하였다.
추출물 분석은 Agilent 사의 5973 MS가 장착된 Agilent 사의 6890 GC를 이용하였다. 컬럼은 DB-5MS(길이 30 m, 내경 0.25 mm, 필름 두께 0.25 mm, Agilent Technology Inc.)를 사용하였다. 주입구 온도는 250°C, 분할비는 1 : 15 이며 이동상 기체는 헬륨(3.0 mL/min)을 사용하였다. 컬럼 오븐은 70°C에서 3분간 유지하고 분당 10°C의 속도로 300°C까지 올린 후 4분간 유지하는 것으로 프로그래밍하였다. 전자 이온화(electron ionization)을 이용하여 분석물을 이온화하였으며 MS source 온도는 230°C로 설정하였다.
Results and Discussion
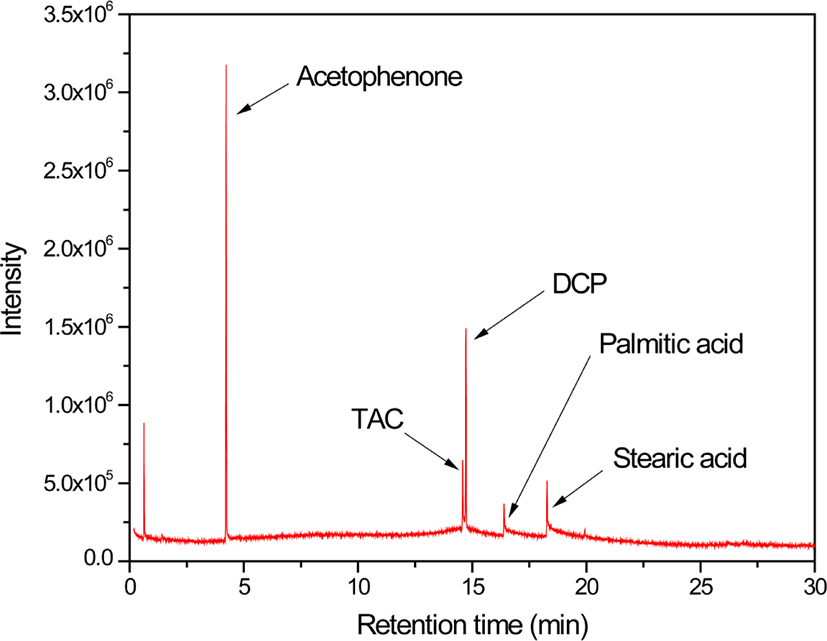
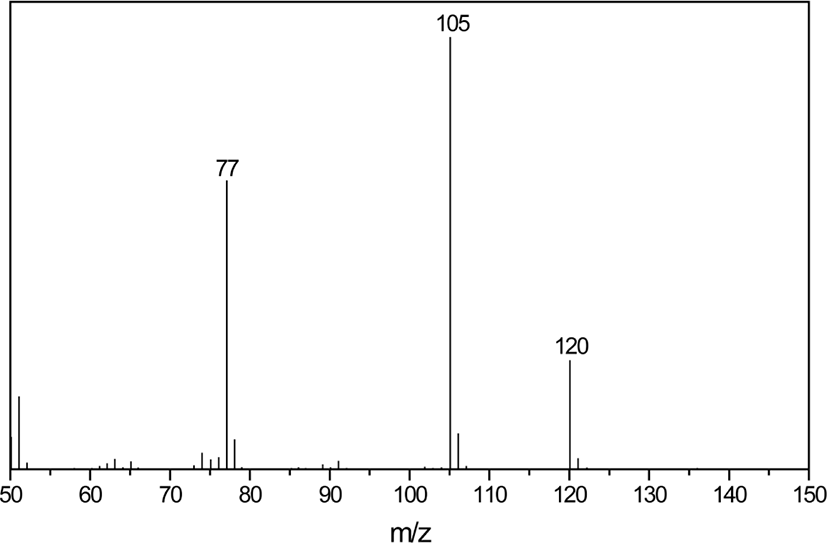
Figure 1은 원재료 DCP, TAC, 스테아린산을 아세톤에 용해시킨 혼합액을 분석하여 얻은 GC/MS 크로마토그램이다. TAC, DCP, 스테아린산은 각각 14.59 분, 14.73 분, 18.28 분에서 검출되었다. 16.39 분에 나타난 것은 원재료 스테아린산에 혼합된 팔미트산(palmitic acid)이다. 원재료 이외에 4.23 분에 새로운 피크가 나타났다. 이 피크에 대한 질량 스펙트럼을 Figure 2에 나타내었으며, 이는 아세토페논으로 확인되었다. 아세토페논은 DCP의 분해에 의해 생성된 것으로(Scheme 2), GC의 시료 주입구 온도가 250°C로 DCP의 분해 온도(160°C 이하)16보다 높아 발생한 것이다. DCP는 열적으로 불안정하기 때문에 GC를 이용하여 정량분석하는 것은 곤란하지만, 일부 DCP는 분해되지 않아 검출할 수 있어서 GC/MS를 이용하여 미반응 잔류 DCP를 정성분석하는 것은 가능하다. Scheme 2에 묘사한 바와 같이 DCP의 분해에 의해 생성된 cumyl oxide 라디칼에 의해 생성될 수 있는 생성물은 아세토페논과 2-페닐-2-프로판올이다. 하지만, 원재료 DCP를 GC/MS로 분석한 결과, 고온의 시료 주입부를 통과하여 다수의 DCP가 분해되었음에도 불구하고 2-페닐-2-프로판올은 검출되지 않았다. 이는 2-페닐-2-프로판올이 생성되기 위해서는 cumyl oxide 라디칼이 다른 분자로부터 수소를 공급받는 수소취합반응(hydrogen abstraction reaction)이 이루어져야 하지만, GC/MS의 시료 주입부는 온도가 높아 대부분 화합물이 기체 상태로 존재하므로 수소를 공급받을 수 있는 적절한 공급원이 가까이 있지 않기 때문에 2-페닐-2-프로판올이 형성되지 않은 것으로 해석할 수 있다.
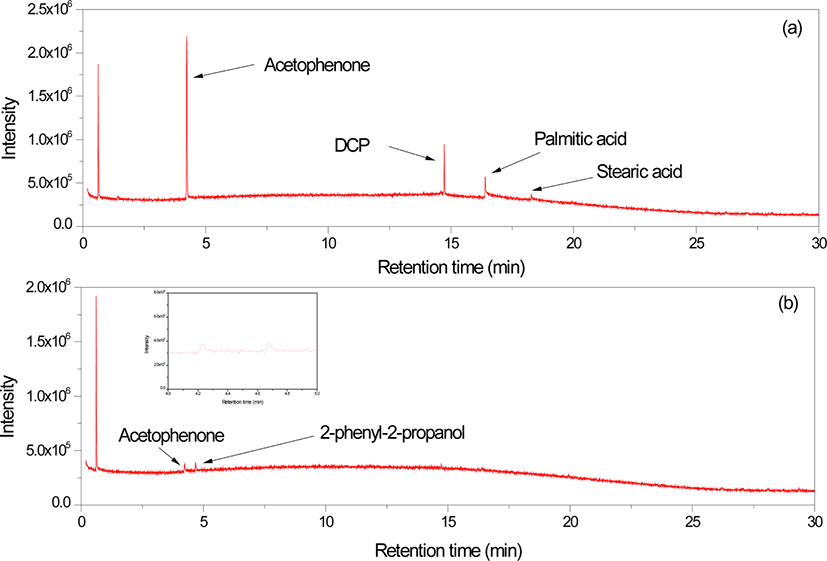
HD 배합물과 가교물의 추출물에 대한 GC/MS 크로마토그램을 Figure 3에 나타냈다. HD 배합물에서는 DCP, 팔미트산, 스테아린산, 그리고 아세토페논이 검출되었다. 원재료 DCP를 분석하여 얻은 아세토페논/DCP의 봉우리 면적 비는 2.80 (Figure 1)이고 HD 배합물에서의 면적 비는 3.95 (Figure 3)로, 배합물에서의 아세토페논/DCP의 봉우리 면적 비가 더 크다. 이는 검출된 아세토페논 중 일부는 GC 시료 주입부에서 분해하여 생성된 것이 아니라 배합 중 DCP가 분해하여 생성된 것이라는 증거이다. 따라서, 원재료 DCP와 배합물의 추출물 분석 결과 중 아세토페논/DCP의 봉우리 면적 비를 비교하면 배합 중 분해된 DCP의 양을 어느 정도 결정할 수 있을 것으로 여겨진다. EVA 배합물을 제조할 때, 배합 온도는 DCP가 분해되지 않을 정도의 온도를 유지하지만 국부적으로 마찰에 의한 온도 상승이 있을 수 있으므로 배합 중 일부 DCP가 분해되어 아세토페논이 형성된 것으로 볼 수 있다.
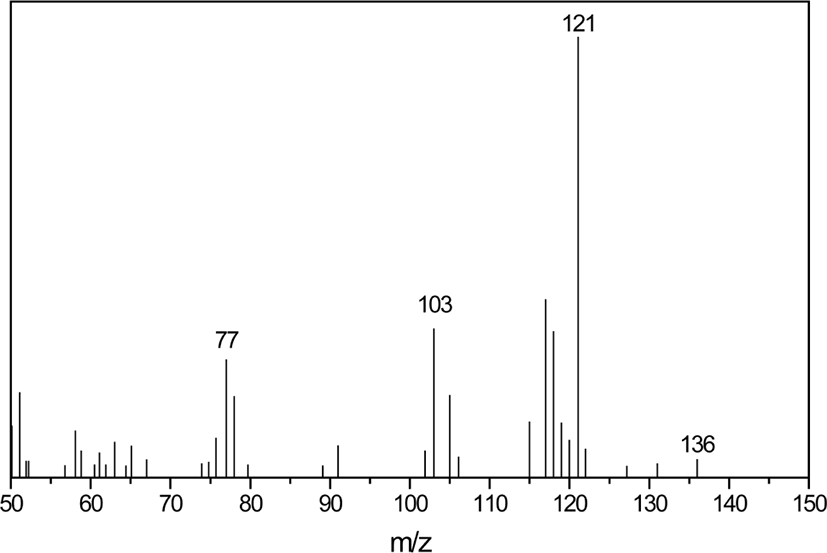
HD 가교물에서는 DCP, 팔미트산, 스테아린산은 검출되지 않았으며 아세토페논과 머무름 시간 4.68 분에 다른 새로운 생성물이 검출되었다. 이 피크에 대한 질량 스펙트럼을 Figure 4에 나타내었으며, 이는 2-페닐-2-프로판올로 확인되었다. 가교물에서 스테아린산과 팔미트산이 검출되지 않은 것은 배합과 가교 과정 중 이들 지방산과 산화아연이 반응하여 불용성 아연지방산염이 형성되었기 때문으로 해석할 수 있다. HD 가교물에서 DCP가 검출되지 않았다는 것은 가교 반응 중 DCP는 모두 분해되었다는 것을 의미하며, HD 가교물에서 검출된 아세토페논은 GC 시료 주입부에서 분해된 것이 아니라 가교 반응에 의해 생성된 것임을 의미한다. Scheme 2와 같이 분해된 cumyl oxide 라디칼에서 메틸기가 떨어지면서 재배열이 일어나 아세토페논을 형성한다.12 혹은 cumyl oxide 라디칼이 EVA 사슬의 수소를 취하여 2-페닐-2-프로판올이 형성된다. 따라서 HD 가교물에서의 2-페닐-2-프로판올의 검출은 cumyl oxide 라디칼의 EVA로부터의 수소취합반응이 일어난 것을 의미한다.
배합물에서는 검출되지 않은 2-페닐-2-프로판올이 가교물에서만 검출되었다는 것은 흥미로운 것이다. 앞서 기술하였듯이 GC/MS의 시료 주입구를 지나면서 일부 DCP가 분해하여 아세토페논이 형성되었으며 배합 중에도 일부 DCP가 분해되어 아세토페논이 형성되었다. 하지만, 2-페닐-2-프로판올은 원재료 DCP를 GC/MS로 분석하였을 때나 배합물에서도 발견되지 않았으며, 가교물에서만 검출되었다. 배합 공정과 가교 공정의 차이는 온도와 구성 성분 간의 밀착도이다. 배합 공정에 비해 가교 공정의 온도가 훨씬 높고 구성 성분 간의 밀착도도 훨씬 높다. 따라서, cumyl oxide 라디칼이 분자 내 자체 재배열에 의해 아세토페논이 생성되는 과정보다 수소취합반응에 의해 2-페닐-2-프로판올이 형성되는 과정이 에너지가 더 필요하고 구성 성분이 좀 더 가까이 위치해야 가능하다는 것을 알 수 있다. GC/MS의 시료 주입부는 온도가 높아 2-페닐-2-프로판올의 형성에 유리할 수 있지만, 수소를 공급해 줄 적절한 공급원과 만날 가능성이 매우 희박하여 분자 내 재배열에 의한 아세토페논의 형성만 이루어진다.
Figure 5는 HDT 배합물과 가교물의 GC/MS 크로마토그램이다. HDT 배합물에서는 DCP, TAC, 팔미트산, 스테아린산, 그리고 아세토페논이 검출되었다. HD 배합물과 마찬가지로 HDT 배합물의 아세토페논/DCP의 봉우리 면적 비는 3.00 (Figure 5)으로 원재료에 비해서 높지만, HD 배합물에서의 면적 비보다 작다. 이는 배합 과정 중 DCP가 분해되어 생성된 cumyl oxide 라디칼이 TAC와 반응하여 아세토페논의 생성이 줄어든 것으로 해석할 수 있다.
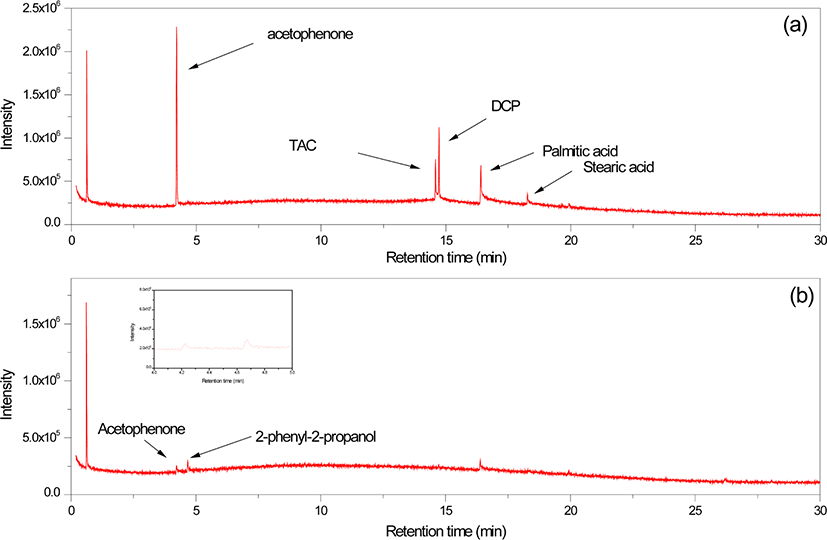
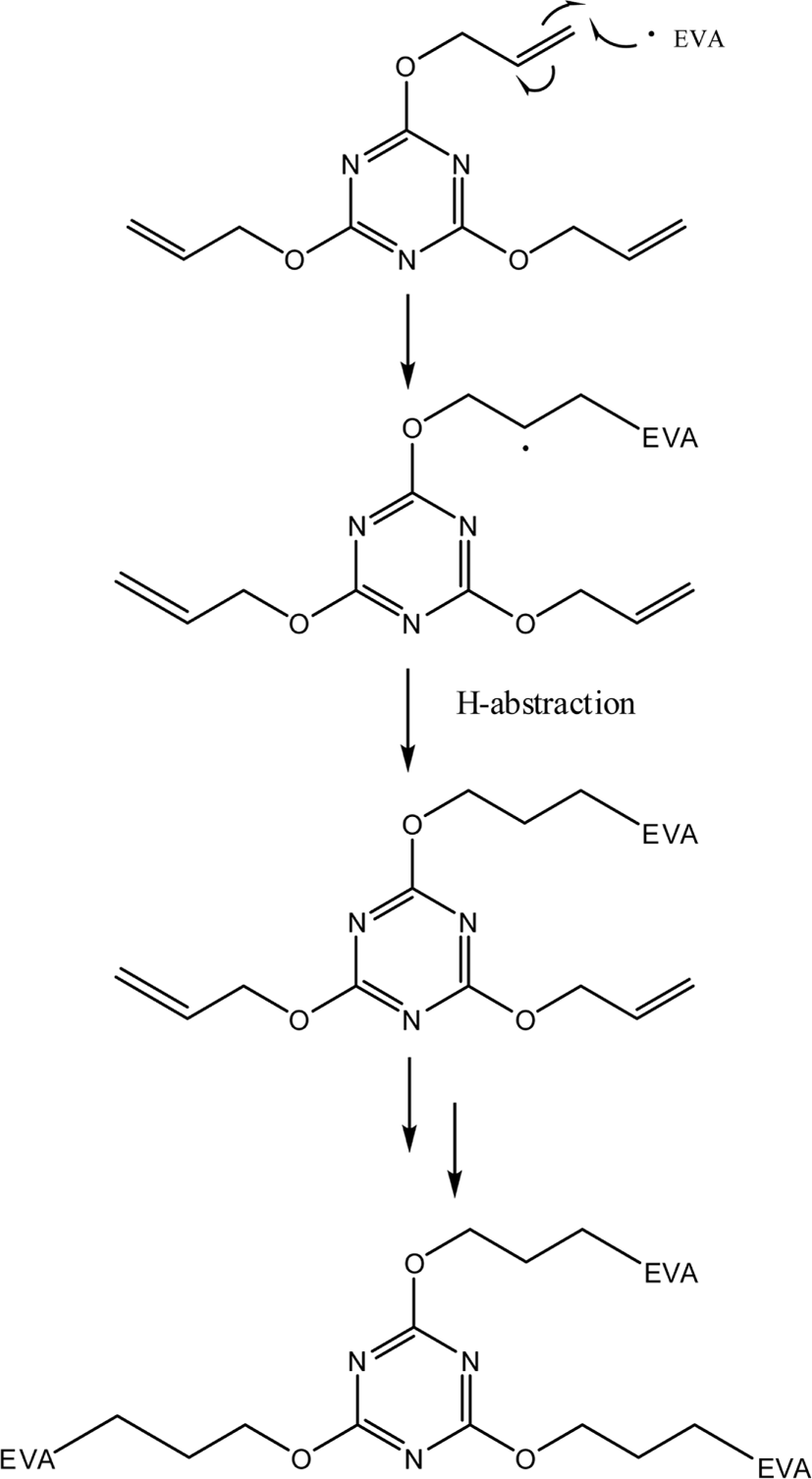
HDT 가교물에서는 DCP, TAC, 팔미트산, 스테아린산은 검출되지 않았으며 아세토페논과 2-페닐-2-프로판올이 검출되었다. HDT 가교물에서 TAC가 검출되지 않는 이유는 Schemes 3과 4와 같이 TAC가 가교 과정 중 발생한 라디칼과 반응하는 것으로 설명할 수 있다. DCP의 분해에 의해 생성된 cumyl oxide 라디칼은 TAC의 말단 탄소-탄소 이중결합(~C=C~)과 쉽게 반응하여 TAC 라디칼이 형성된다(Scheme 3). 이 TAC 라디칼은 EVA 라디칼과 반응하여 EVA 사슬과 결합할 수 있다. 이러한 과정이 반복되면 DCP의 분해에 의해 생성된 cumyl oxide 라디칼은 TAC와 반응하여 EVA 사슬과 가교결합이 형성된다. 혹은 TAC 라디칼이 EVA 사슬에서 수소를 취하여 단순히 TAC의 말단 이중 결합이 포화되는 반응이 일어날 수도 있다. 또한, cumyl oxide 라디칼 등과 반응하여 형성된 EVA 라디칼이 TAC의 말단 이중 결합과 반응하여 TAC 라디칼이 형성되는 것도 가능하다(Scheme 4). 따라서 TAC의 말단 탄소-탄소 이중결합은 라디칼과 쉽게 반응할 수 있으므로 가교 과정 후에는 거의 모든 TAC가 반응하여 EVA 사슬에 결합되어 있으므로 추출되는 것이 거의 없을 것이다. HD 가교물과 HDT 가교물에서 아세토페논/2-페닐-2-프로판올의 봉우리 면적 비는 각각 0.64와 0.60으로 HD 가교물에서 약간 높다. 이는 배합 중 생성된 아세토페논의 함량이 HD 배합물에서 더 높기 때문인 것이 중요한 이유라 할 수 있다.
Conclusions
GC/MS로 원재료 DCP를 분석한 결과, DCP 자체로 검출되는 것이 있고 일부 DCP는 시료 주입부에서 분해되어 아세토페논으로 검출되었으나 2-페닐-2-프로판올은 검출되지 않았다. 배합물에서도 DCP와 아세토페논은 검출되었으나 2-페닐-2-프로판올은 검출되지 않았다. 2-페닐-2-프로판올은 오로지 가교물에서만 검출되었다. 2-페닐-2-프로판올은 cumyl oxide 라디칼이 수소취합반응에 의해서 생성되는 것이므로 바로 옆에 수소 제공원이 있어야만 생성이 가능하다. GC/MS 시료 주입부는 고온이어서 용매와 분석물이 모두 기체 상태이므로 수소취합반응이 일어나기 곤란하다. 배합 공정은 온도가 그다지 높지 않아 DCP의 분해가 잘 일어나지 않지만 일부 DCP가 분해되어 생성된 아세토페논은 생성되나, 압축이 덜 된 상태여서 2-페닐-2-프로판올은 생성되지 않은 것으로 여겨진다. 가교 공정에서는 압축된 상태이므로 분자 간 거리가 가까워 cumyl oxide 라디칼의 수소취합반응이 쉽게 일어날 수 있어서 2-페닐-2-프로판올이 생성될 수 있다. TAC는 가교 과정 중 cumyl oxide 라디칼이나 EVA 라디칼과 반응하여 가교물에서는 추출되지 않았다.