Introduction
최근 바이러스에 대한 관심이 증가함에 따라 항균성이 있는 소재가 대두되고 있다. 항균제는 유기계와 무기계가 있으며 무기계 항균제1는 은, 구리, 아연 및 TiO2 등이 있고 유기계 항균제2는 요오드 화합물, 알코올 그리고 키토산 등이 있다. 대부분의 유기계 항균제는 무기계 항균제보다 고온에서 항균 효과의 지속성이 짧고 인체에 대한 안정성이 낮지만 키토산은 유기계 항균제 중 천연물질이므로 인체에 무해하다.
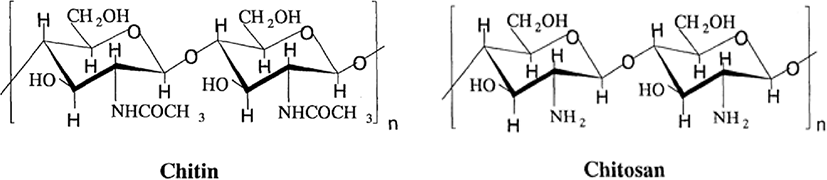
천연계 항균물질인 키토산[poly(2-amino-2-deoxy-D-glucose)]은 자연계에서 셀룰로스 다음으로 많이 존재하는 다당류의 천연물질이다.3 그리고 게, 새우 등의 갑각류로부터 추출한 키틴은 유기용매에 대한 용해성 뿐만 아니라 화학적 반응성이 낮아 산업적인 이용에 제한적이었지만, 키틴의 탈아세틸화물인 키토산은 묽은 산에 용해가 가능하다는 점 뿐만 아니라 반응성이 뛰어난 유리 1차 아민기를 가지고 있기 때문에 화학적 변성이 용이하여 특히 약산성 고분자 전해질로서 특정 영역에서 부합하는 기능성 재료로서의 사용이 가능한 것으로 알려져 있다. 키틴을 알칼리로 탈아세틸화하면 항균 활성이 좋고 무독성이며 살아있는 조직과의 호환성이 높아 좋은 생체 재료인 키토산을 제조할 수 있다.4
양전하를 띤 일반적인 항균제에 있어서 항균성의 메카니즘은 다음과 같은 과정5을 거치게 된다. 양이온의 박테리아 세포 표면에 흡착하여 세포벽을 통한 양이온 확산을 통해 양이온과 세포질 막과의 결합하여 세포질 막을 파괴한 후, DNA 및 RNA와 같은 세포질 구성 물질의 방출 그리고 세포 사멸과 같은 과정을 거치게 된다.
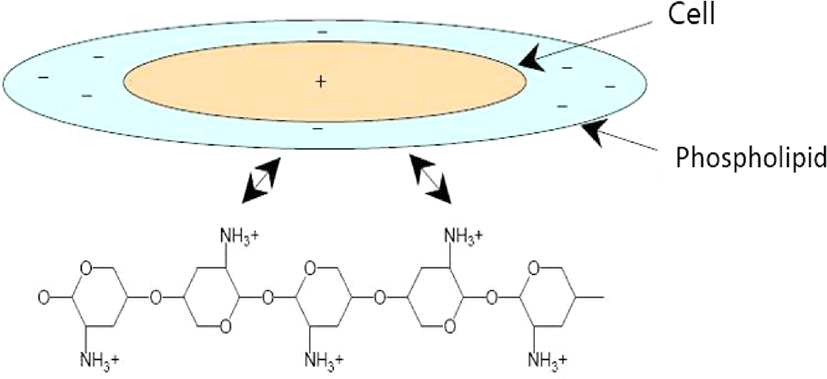
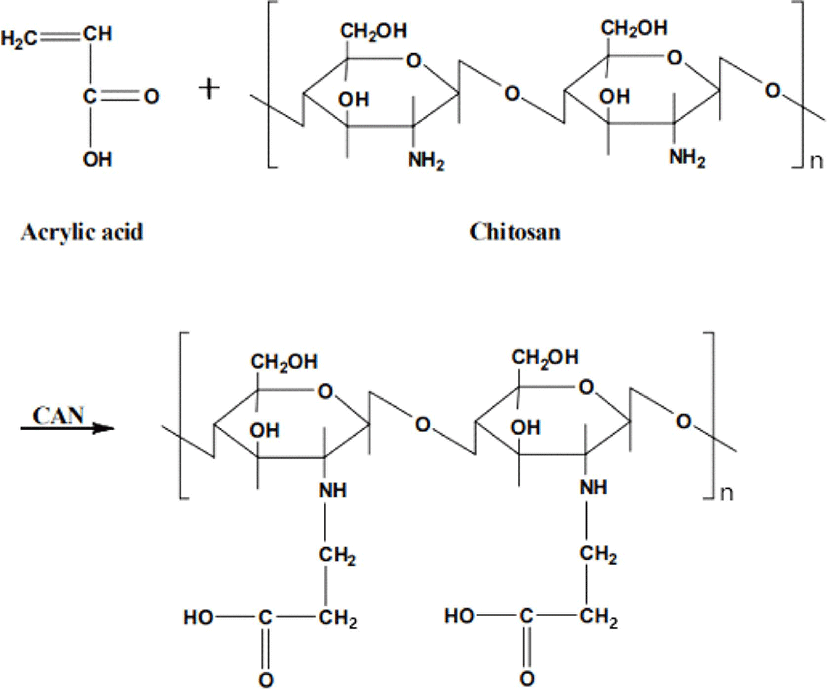
키토산은 Figure 1에 제시된 바와 같이 아미노기(NH3+)의 양이온화에 의해 활성이 되므로 키토산을 분산시키는 용매의 pH가 높은 용액일수록 양이온화 된 아미노기의 비율이 감소되어 항균성이 저하6된다. 키토산의 양이온화 된 아미노기와 세균의 세포벽을 구성하는 시알산, 인지질 등의 산성기 간에 이온결합이 일어나 고분자 전해질 복합체를 형성한다. 그 결과, 세포막 중 인지질의 극성화로 인해 접촉면 반대측의 세포막 조직이 파괴되고 세포 내의 원형질이 누출되어 세균이 사멸해 항균 활성7을 나타낸다. 그러나 키토산은 낮은 기계적 강도와 열적 안정성 그리고 기체 차단 성질들로 인하여 응용하는데 한계를 가지고 있을 뿐만 아니라 키토산 분자 내의 견고한 수소결합 등으로 인해 산성 영역에서만 용해되는 등 용해성이 제한적이다.8-10그러므로 마이크로 또는 나노크기의 충진제를 사용하거나 그라프트화하여 키토산의 물성을 향상시킬 수 있다. 또한 키토산을 그라프트시키기 위한 ceric ammounium nitrate (CAN)는 강한 산화제로서 수산기, 아민기 등의 환원성기가 있는 유기물과 용이하게 착물을 형성하여 매우 쉽게 그라프트하는 것으로 알려져 있다.11Figure 2와 Figure 3은 각각 아크릴산과 아크릴아마이드를 이용하여 키토산 유도체를 제조한 분자구조이며 아크릴산과 아크릴아마이드가 키토산의 아미노기에 결합되어 아미노기를 강화시킴3을 알 수 있다.
따라서 본 연구에서는 유기계 항균 물질중, 안전한 물질로 여겨지는 천연계인 키틴12을 탈아세틸화시켜 항균 활성이 부여된 키토산을 합성하고, 이중 항균성이 우수한 키토산을 사용하여 아크릴산과 아크릴아마이드의 그라프트를 통해 키토산 유도체를 합성하였다. 키토산의 탈아세틸화된 정도와 키토산 유도체에 합성시킨 아크릴산과 아크릴아마이드의 양에 따른 반응을 1H-NMR과 FT-IR 분석을 통하여 확인하였고, 이에 따른 Bacillus, E. coli 그리고 S. aureus를 이용한 항균 효과에 대하여 고찰하였다.
Experimental
키토산 제조를 위해 Chitin (Daejung. Co.)을, 탈아세틸화도 향상을 위해 97% NaOH (Daejung. Co.)를 사용하였고 세척제로 99% Ethyl ether (C4H10O, Daejung. Co.)와 94.5% Ethyl alcohol (C2H5OH, Daejung. Co.)을 사용하였다. 키토산 유도체 합성을 위해 99.5% Acetic acid (CH3COOH, Daejung. Co.), 98% Acrylamide (이하 Aam, C3H5NO, Daejung. Co.)와 99% Acrylic acid (이하 Aa, C3H4O2,Daejung. Co.), 그리고 그라프트를 위해 97% Cerium ammonium nitrate (이하 CAN, CeH8N8O18, Daejung. Co.)를 사용하였다. 재결정을 위해 99.98% Acetone (C3H6O, SK chemical. Co.)을 사용하였다.
키틴에 수산화나트륨 용액을 첨가하여 탈아세틸화시키고 중성이 되도록 증류수에 세척하여 건조한 후, 에탄올과 에테르 순서로 세척 건조하여 키토산을 제조하였다. Table 1에는 사용된 물질의 종류와 그 함량 그리고 수산화나트륨에 따른 조성을 나타내었다.
| Sample \ Ingredients | Chitin | NaOH | H2O |
|---|---|---|---|
| Cs-10 | 2.9 | 9.7 | 87.4 |
| Cs-30 | 2.9 | 29.1 | 68.0 |
| Cs-47 | 2.9 | 45.6 | 51.5 |
키토산에 아세트산과 Aa 및 Aam을 첨가하여 반응시킨 후, CAN 용액을 첨가하여 반응시킨다. 아세톤으로 재결정하여 여과하고 감압 건조한 후, 메탄올로 추출하여 60oC/6hr 항량이 될 때까지 건조하여 키토산 유도체를 제조하였다. Table 2에는 사용된 물질의 종류와 그 함량 그리고 Aa와 Aam에 따른 조성을 나타내었다.
톨루이딘블루 지시약을 이용한 콜로이드 적정법13을 사용하여 탈아세틸화도를 측정하였다. 키토산을 아세트산에 녹인 후, 이 용액 1g과 증류수를 첨가하여 교반한다. 톨루이딘블루를 첨가하고 potassium polyvinyl sulfate solution (P.V.S.-K)로 적정하여 다음 식에 따라 키토산의 탈아세틸화도를 구하였다.
X = 1/400 × 1/1000 × f × 161 × V
Y = 0.5 × 1/100 X
V : N/400 Potassium polyvinyl Sulfate Solution 소비량(mL)
f : N/400 Potassium polyvinyl Sulfate Solution 규정농도 계수
161 : 키토산의 단일 분자량
203 : 키틴의 단일 분자량
탈아세틸화도에 따른 키토산과 Aa과 Aam의 첨가량에 따른 키토산 유도체의 화학 구조를 확인하기 위하여 Fourier transform infrared (FT-IR) spectroscopy (Cary670, Agilent)과 400 MHz 1H-NMR (AVANCE III 400 MHz, Bruker)을 사용하였다.
합성한 키토산과 키토산 유도체의 항균성 평가를 위해 Bacillusamyloliquefaciens (KCCM 12090)와 Escherichia coli (KCCM 11591)를 37oC에서 배양시켜 사용했으며 항균성 평가는 디스크 확산법(NCCLS M100-S5)을 통해 분석하였다. LB배지에 각각 배양시킨 Bacillus와 E. coli를 도포 후, 배지 위에 대조군으로 사용할 깨끗한 디스크와 실험군으로 쓰일 키토산과 키토산 유도체를 도포한 디스크를 올리고 인큐베이터에서 일정 시간 배양시켰다.
이중 높은 항균 특성을 보인 키토산 유도체의 균 감소 율을 확인하기 위하여 Escherichia coli (KCCM 11591) 및 Staphylococcus aureus (KCCM 16404)을 사용하고 ASTM E2149 규격에 따라 항균 실험을 진행하였으며 균 감소율은 다음과 같은 식으로 측정했다.
위의 식에서 A는 시험군의 일정시간 후 생균수의 평균 그리고 B는 대조군의 일정시간 후 생균수의 평균을 의미한다.
Results and Discussion
키틴에 아세틸이 많이 존재하므로 이 키틴의 아세틸을 제거하는 반응을 통해 키토산이 제조된다.10 수산화나트륨의 함량에 따라 탈아세틸화도를 조절10할 수 있으며 질소에 붙은 아세틸기가 제거되어 수용액 상태에서 항균성에 영향을 미치는 양이온화된 아미노기가 생성된다.
키틴에 수산화나트륨을 9.7%, 29.1% 및 45.6%를 첨가하여 탈아세틸화된 키토산을 콜로이드 적정법을 이용하여 탈아세틸화도10를 측정한 결과 각각 10%, 30%, 그리고 47%의 탈아세틸화도를 갖는 키토산을 제조하였다.
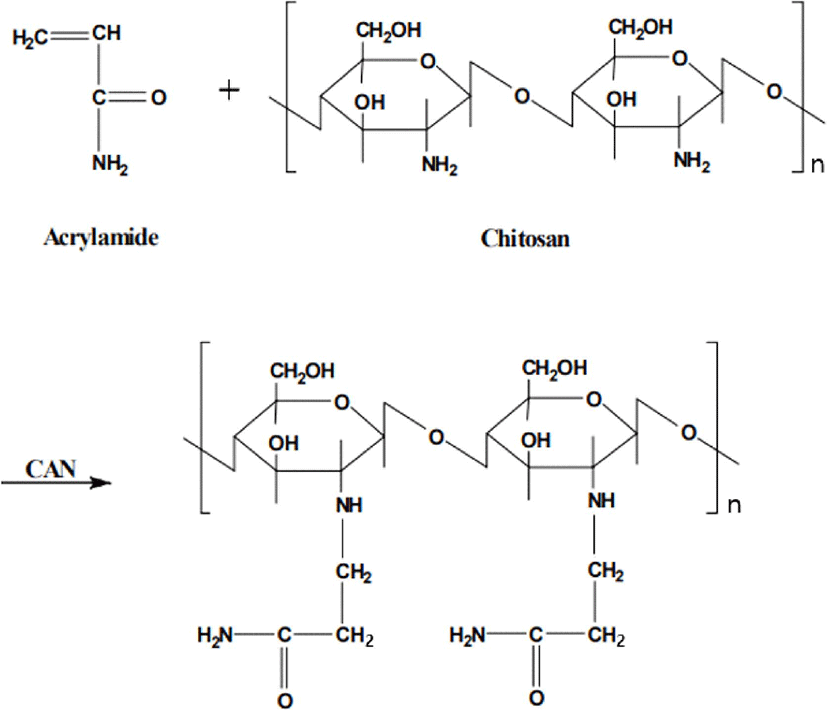
Figure 4는 키틴과 키토산의 분자 구조를 나타내었고 제시된 바와 같이 키틴의 탈아세틸화 반응을 통하여 제조된 키토산의 구조에서 카르보닐기가 제거됨을 알 수 있다. Figure 5는 10%, 30% 및 47% 탈아세틸화도를 갖는 키토산의 FT-IR 분석 결과를 (a) Cs-10, (b) Cs-30과 (c) Cs-47에 나타내었으며, 아미드기와 카르보닐기에 관련된 밴드를 관찰할 수 있었다. Figure 5에서 제시된 바와 같이 (a), (b) 및 (c) 모두 C=O의 신축 진동14,15에 해당하는 1,619 cm-1, -NHCO기로 인한 amid Ⅰ14,15에 해당하는 1,655 cm-1의 흡수 피크를 확인하였다.또한 N-H 굽힘 진동은 C-N 신축모드와 혼합된 amid II14,15 (1차 아민의 N-H bending vibration)에 해당하는 1,555 cm-1피크로 확인할 수 있었다. FT-IR의 흡광도와 농도는 비례하므로 작용기의 농도가 감소함에 따라 흡광도 또한 감소하여 피크는 작아진다.16 따라서 Figure 4에 제시한 바와 같이 키틴으로부터 키토산을 합성 시에 키틴의 카보닐기와 1차 아민기가 제거되므로 Figure 5에서 키토산의 탈아세틸화도가 (a), (b), (c) 순서로 더 증가됨에 따라 각각 amid I과 amid II 밴드 그리고 카르보닐기가 감소됨을 확인하였으며 이 결과 키틴의 탈아세틸화 반응이 진행되었음을 확인 할 수 있었다.
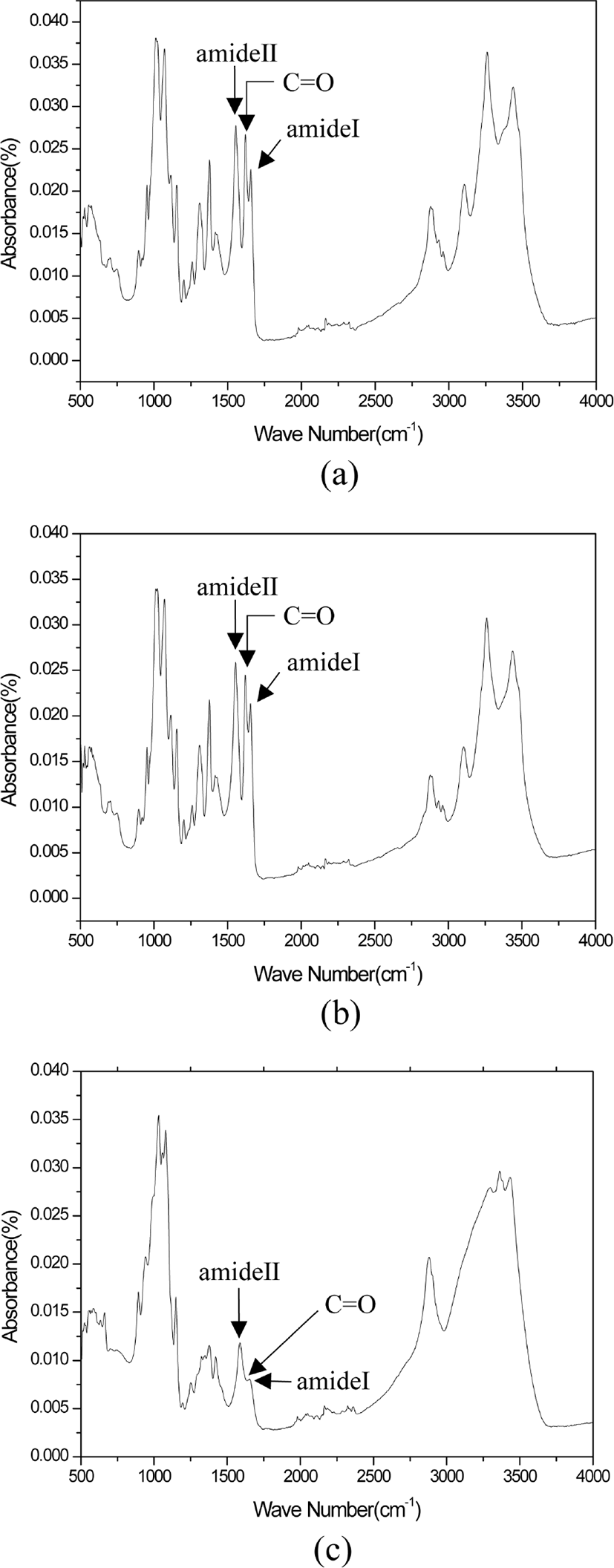
Figure 6은 Aa를 0.6%, 1.0% 및 1.3%를 첨가하여 제조한 키토산 유도체의 FT-IR 분석 결과를 (a) Aa-0.6, (b) Aa-1.0과 (c) Aa-1.3에 나타내었다. 아크릴의 이중결합의 반응이 일어나면서 생긴 카르보닐 그룹17에 해당하는 피크가 대략 1,625 cm-1부근에서 확인되었고, amide II17에 해당하는 키토산의 1차 아민 특성 피크인 1,524 cm-1을 확인하였다. 따라서 키토산에 Aa가 그라프트 되었음을 알 수 있으며, Aa의 양이 증가함에 따라 C=O와 amide II의 피크가 다소 높아지므로 카르복실기와 1차 아민의 농도가 증가되었음을 확인할 수 있었다. Figure 7은 Aam을 0.6%, 1.0% 및 1.3%를 첨가하여 제조한 키토산 유도체의 FT-IR 분석 결과를 (a) Aam-0.6, (b) Aam-1.0와 (c) Aam-1.3에 나타내었으며 Aam의 이중결합의 반응이 일어나면서 생긴 카르보닐 그룹17에 해당하는 1,623 cm-1피크를 확인하였고, amide II17에 해당하는 키토산의 1차 아민 특성 피크인 1,523 cm-1을 확인하였다. 그러므로 키토산에 Aam이 그라프트 되어 있다고 해석되며, Aam의 양이 증가함에 따라 C=O와 amide II의 피크가 다소 높아지므로 마찬가지로 카르복실기와 1차 아민의 농도가 증가되었음을 확인할 수 있었다.
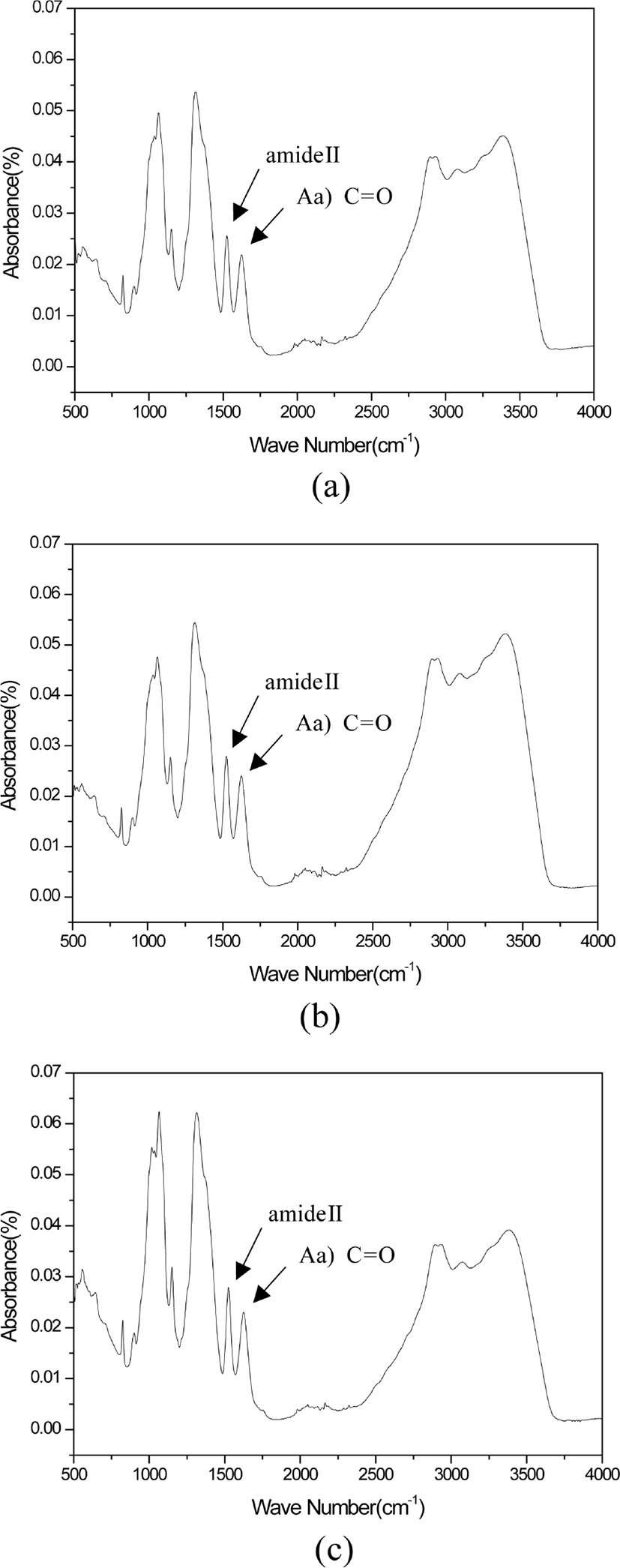
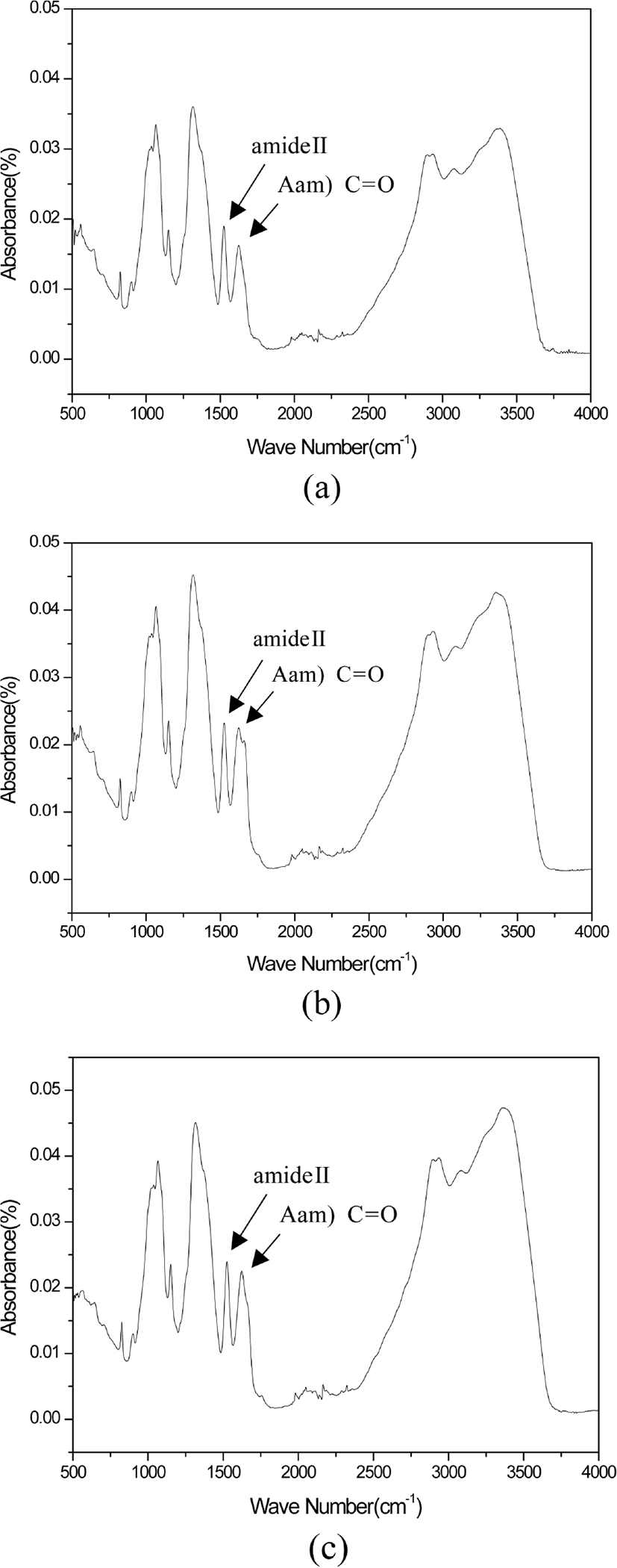
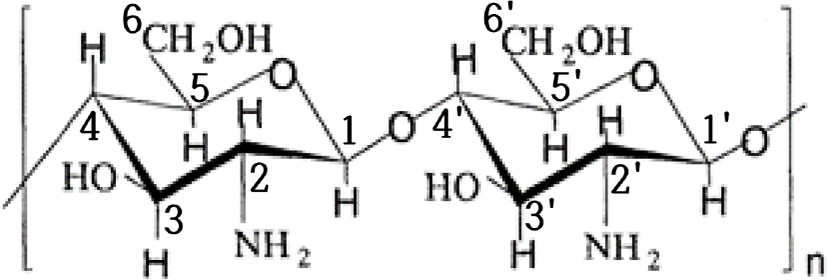
Figure 8은 키토산의 분자 구조를 나타내었고 각 숫자는 탄소의 위치를 나타낸다. Figure 9는 10%, 30% 및 47% 탈아세틸화도를 갖는 키토산의 1H-NMR 분석 스펙트럼의 결과를 (a) Cs-10, (b) Cs-30와 (c) Cs-47에 나타내었다. Figure 8의 키토산 구조의 탄소 3-6자리18에 해당하는 3.7~3.9 ppm을 확인하였고, 탄소 2자리18에 해당하는 3.4 ppm을 확인하였다. 또한 키틴의 탈아세틸화된 탄소(CH3-CO-NH-)에 붙은 수소 핵의 흡수18에 해당하는 2.2 ppm을 확인하였다. 1H-NMR의 피크 면적은 원자 수에 비례하므로 원자 수가 감소하면 피크 면적이 감소되어 같은 조건일 때 피크는 작아진다.19따라서 Figure 9를 통해 탈아세틸화도가 증가하는 (a) Cs-10, (b) Cs-30, (c) Cs-47 순으로, 2.2 ppm에서 키토산의 아세틸화된 탄소(CH3-CO-NH-)에 붙은 수소의 피크가 감소됨을 확인할 수 있으며 이를 통해 키틴의 탈아세틸화 반응이 진행되어 키토산이 합성되었다고 판단된다.
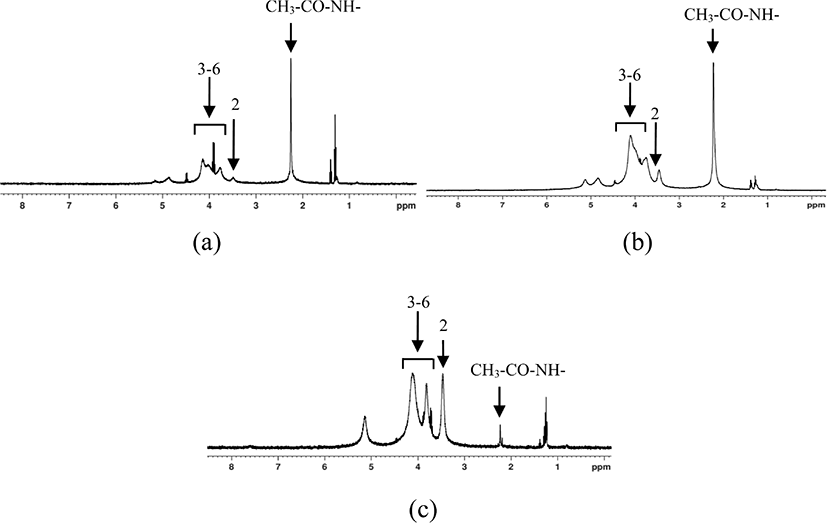
Figure 10은 키토산 유도체의 분자 구조를 나타내었고, 각 숫자는 탄소의 위치를 나타낸다. Figure 11은 Aa를 0.6%, 1.0% 및 1.3%를 첨가하여 제조한 키토산 유도체의 1H-NMR 분석 결과를 (a) Aa-0.6, (b) Aa-1.0과 (c) Aa-1.3에 나타내었으며, Figure 10에서 제시된 키토산 유도체의 탄소 3-6자리19에 해당하는 3.7~3.9 ppm에서 피크를 확인하였고, 탄소 2자리19에 해당하는 3.1 ppm 피크를 확인하였다. 또한 Aa는 CH2=CH-20에 해당하는 피크가 4.2 ppm과 5.7~6.0 ppm에서 나타나지만, Aa가 그라프트 된 키토산 유도체의 경우 Aa의 이중결합이 단일결합으로 바뀐 탄소 2자리 중에서 -CH2-CH2-19에 해당하는 피크가 2 ppm에서 확인 되므로 키토산 유도체가 합성되었다고 판단된다. Figure 12는 Aam을 0.6%, 1.0% 및 1.3%를 첨가하여 제조한 키토산 유도체의 1H-NMR 분석 결과를 (a) Aam-0.6, (b) Aam-1.0과 (c) Aam-1.3에 나타내었으며, Figure 10에서 제시된 키토산 유도체의 탄소 3-6자리19에 해당하는 3.7~3.9 ppm, 탄소 2자리19에 해당하는 3.1 ppm에서 피크를 확인하였다. 또한 Aam도 그라프트 된 키토산 유도체의 경우 같은 경향성을 갖고, Aam의 이중결합 피크가 감소하고 단일결합으로 바뀐 탄소 2자리 중에서 -CH2-CH2-19에 해당하는 2 ppm에서 피크가 확인되므로 키토산 유도체가 제조되었다고 판단된다.
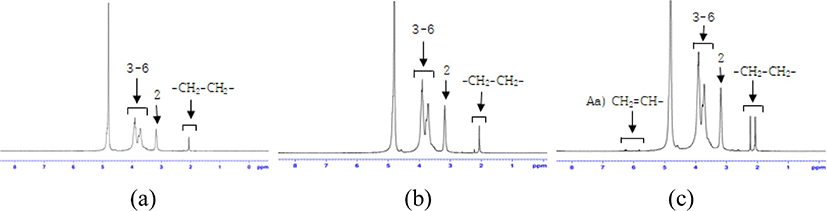
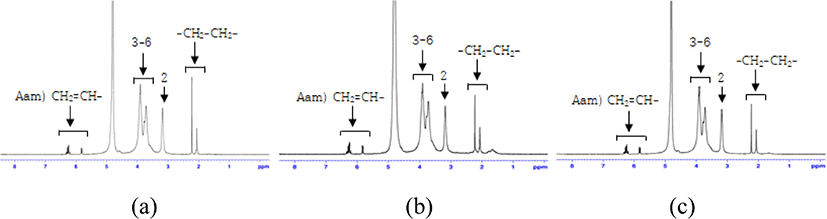
따라서 Figure 11과 Figure 12에서와 같이 -CH2-CH2-에 해당하는 피크가 2ppm에서 확인되므로 키토산 유도체에 Aa 및 Aam이 그라프트되었다고 사료된다.
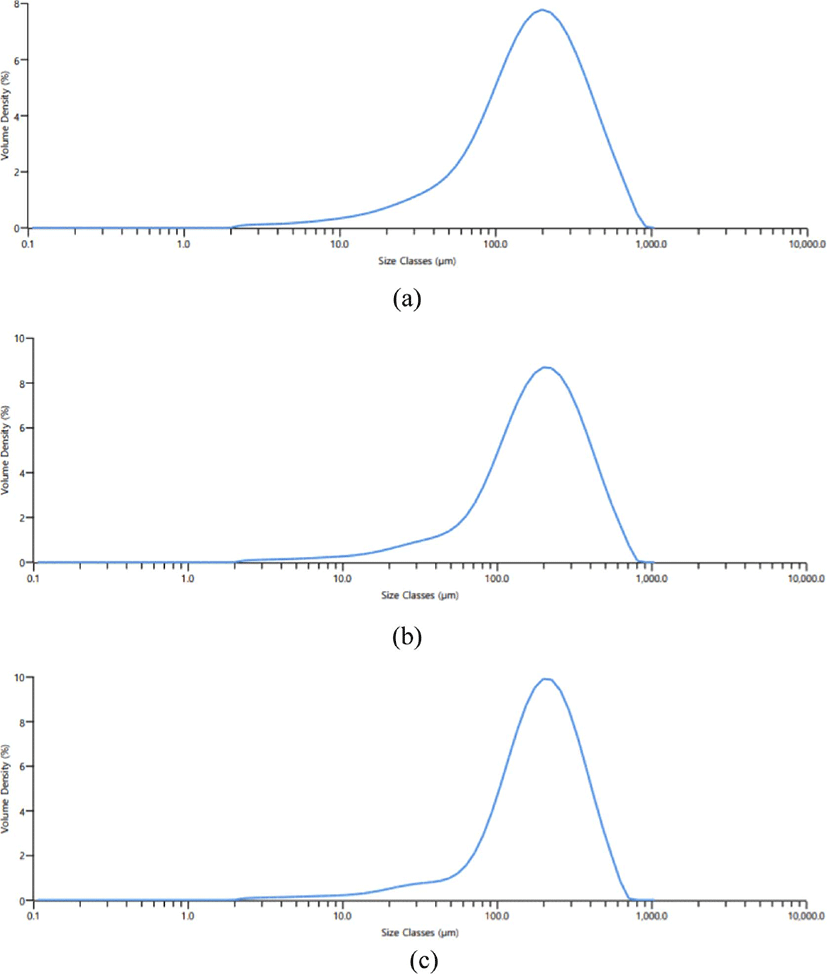
Figure 13은 10%, 30% 및 47% 탈아세틸화도를 갖는 키토산의 입도분석 결과를 (a) Cs-10, (b) Cs-30와 (c) Cs-47에 나타내었으며 (a)는 111 μm~352 μm, (b)는 111 μm~310 μm 그리고 (c)는 111 μm~310 μm의 입도분포가 나타났다. 따라서 탈아세틸화도의 정도에 관계 없이 대략 키토산은 111 μm~350 μm 입도 분포를 보이고 있으므로 탈아세틸화도가 입도에 크게 영향을 미치지 않는다는 것을 확인할 수 있었다.
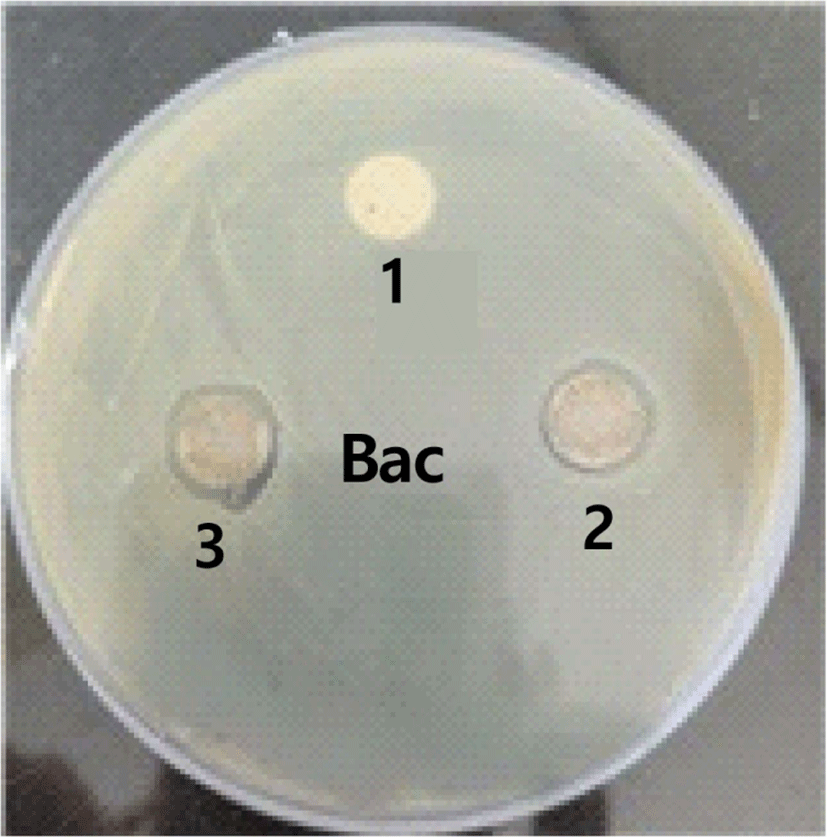
제조한 LB 배지와 E. coli 배지에 항균력 측정을 위한 Bacillus와 E. coli를 도포 후 디스크 확산법(NCCLS M100-S5)에 의한 디스크 주변의 균 성장 유무인 억제대의 크기 측정으로 항균력을 평가하였다.
NaOH 농도가 증가할수록 높은 탈아세틸화도를 보이고 이에 따라 항균 활성을 띠는 아미노기가 증가되므로 항균성이 뛰어나다.7Figure 14는 Bacillus를 이용한 탈아세틸화도에 따른 키토산의 항균 실험 결과로 1은 탈아세틸화도가 10%인 키토산, 2는 30%인 키토산 그리고 3은 47%인 키토산을 나타내었고 Table 3은 이에 따른 키토산의 억제대 크기이다. 탈아세틸화도가 10%인 키토산의 억제대는 거의 나타나지 않았고 30%인 키토산의 억제대는 10 mm 그리고 47%인 키토산의 억제대는 12 mm로 나타났다. 따라서 탈아세틸화도가 47%인 키토산이 억제대의 크기가 가장 크므로 항균 효과가 가장 높음을 확인했으며 이는 탈아세틸화가 진행될수록 세균의 세포벽을 파괴하여 세균을 사멸시키는 양이온화된 아미노기의 함량이 높아지므로 항균 효과가 우수한 것으로 판단되어진다.
| Sample \ Strain | Bacillus |
|---|---|
| Cs-10 | 1 |
| Cs-30 | 10 |
| Cs-47 | 12 |
디스크 확산법의 결과를 통해 항균성이 가장 뛰어난 탈아세틸화도 47%인 키토산을 사용하여 키토산 유도체를 제조 후, Bacillus와 E. coli를 사용한 디스크 확산법으로 항균력 측정을 하였다.
Figure 15는 Aa를 0.6%, 1.0% 및 1.3%를 첨가하여 제조한 키토산 유도체의 Bacillus와 E. coli 항균 실험 결과를 1: Aa-0.6, 2: Aa-1.0 그리고 3: Aa-1.3에 나타내었으며 Table 4는 이에 나타난 디스크의 억제대 크기 결과이다. Bacillus를 이용한 실험 결과에서 Aa-0.6의 억제대는 11 mm, Aa-1.0은 12 mm 그리고 Aa-1.3은 14 mm로 나타났고 E. coli을 통한 시험 결과에서 Aa-0.6의 억제대는 11 mm, Aa-1.0은 13 mm 그리고 Aa-1.3은 15 mm로 Aa 첨가량이 증가함에 따라 억제대의 크기가 증가하였고 이에 항균성 부여에 Aa가 효과적이며 특히 E. coli에 대한 항균 효과가 더 우수한 것으로 보인다. Figure 16은 Bacillus와 E. coli를 이용한 Aam의 양에 따른 키토산 유도체의 항균 실험 결과이며 Table 5는 Aam의 양에 따른 키토산 유도체의 억제대 크기이다. Bacillus를 통한 항균 실험 결과에서 Aam-0.6의 억제대는 12 mm, Aam-1.0은 13 mm 그리고 Aam-1.3은 11 mm로 나타났고 E. coli를 통한 항균 실험 결과에서 Aam-0.6의 억제대는 12 mm, A am-1.0은 12 mm 그리고 Aam-1.3은 13 mm로 Aam 첨가량이 증가함에 따라 Bacillus 및 E. coli에 대한 억제대의 크기가 전반적으로 증가한 것으로 보아 항균성이 부여됨을 확인할 수 있었다. 그러나 Aam-1.3의 경우 Bacillus에 대한 억제대의 크기는 오히려 감소하였다. 이는 키토산을 Aam로 그라프트 했을 경우 Aam 1.3%를 첨가한 Aam-1.3는 Aam의 과도한 첨가로 인하여 효과적으로 그라프트화 되지 못한 Aam으로 상대적으로 알킬기의 길이의 감소로 인하여 균의 성장을 억제하지 못해21Bacillus에 대한 항균성이 오히려 감소한 것으로 판단된다. 또한 Aam이 그라프트 된 키토산 유도체보다 Aa가 그라프트 된 키토산 유도체가 Bacillus 및 E. coli에 대한 억제대가 크기 때문에 더 높은 항균성을 보임을 확인할 수 있었다. 또한 키틴을 탈아세틸화 시켜 합성한 키토산의 항균 특성인 억제대 결과 Table 3과 Aa 및 Aam을 그라프트 된 키토산 유도체와 항균 특성인 Table 4와 Table 5의 억제대 크기를 비교했을 때 키토산 유도체가 더 큰 억제대를 보이므로 항균성이 더 우수하다고 할 수 있다. 이는 그라프트화 되면서 알킬기의 길이가 증가하여 소수성이 더 증가하고 이에 균 증식에 필요한 영양분을 공급 받지 못하여 균의 성장 억제율이 증가22함으로써 더 우수한 항균 특성이 나타난 것으로 보인다.

| Sample \ Strain | Bacillus | E. coli |
|---|---|---|
| Aa-0.6 | 11 | 11 |
| Aa-1.0 | 12 | 13 |
| Aa-1.3 | 14 | 15 |

| Sample \ Strain | Bacillus | E. coli |
|---|---|---|
| Aam-0.6 | 12 | 12 |
| Aam-1.0 | 13 | 12 |
| Aam-1.3 | 11 | 13 |
디스크 확산법을 통하여 억제대가 가장 큰 Aa-1.3과 Aam-1.3인 키토산 유도체를 E. coli 및 S. aureus를 사용하여 ASTM E2149 규격에 따라 앞서서 제시한 균 감소율 식에 따라 항균 특성을 분석하였다. Aa가 그라프트 된 키토산 유도체 중, 가장 높은 항균성을 보인 Aa-1.3의 항균 실험 결과를 Figure 17에 나타내었고 (a)는 S. aureus, (b)는 S. aureus+Aa-1.3, (c)는 E. coli, (d)는 E. coli+Aa-1.3을 도말하여 배양시킨 것으로 99.9% 균 감소율의 결과를 보였다. 또한 Aam이 그라프트 된 키토산 유도체 중, 가장 높은 항균성을 보인 Aam-1.3의 항균 실험 결과를 Figure 18에 나타내었고 (a)는 S. aureus, (b)는 S.-aureus+Aam-1.3, (c)는 E. coli, (d)는 E. coli+Aam-1.3을 도말하여 배양시킨 것으로 99.9% 균 감소율의 결과를 보였다. 아미노기의 농도 증가와 더불어 Aa 및 Aam의 효율적인 그라프트로 소수성을 증가시켜 균 성장에 필요한 영양분을 차단함으로써 높은 균 감소율 결과가 나타난 것으로 판단된다.


Conclusions
FT-IR과 1H-NMR을 통해 키틴의 아미노기 함량이 감소되는 탈아세틸화 반응과 키토산의 Aa와 Aam의 그라프트 반응을 확인하였다. 입도분석을 통해 탈아세틸화된 정도는 키토산의 입자 크기에 영향을 미치지 않는 것을 알 수 있었다. 키토산의 탈아세틸화도 결과 10%, 30% 및 47%를 보였으며 억제대법을 사용한 항균 실험 결과에서 탈아세틸화도가 47%인 키토산의 항균 특성이 가장 높았다. 탈아세틸화 47% 키토산과 Aa 및 Aam의 그라프트를 통한 키토산 유도체의 항균 실험결과 키토산 유도체의 억제대의 크기가 더 컸기 때문에 항균 효과가 더 우수하다는 것을 확인하였다. 또한 Aam이 그라프트 된 키토산 유도체보다 Aa가 그라프트 된 키토산 유도체의 소수성이 더 증가하여 균 성장의 억제 효과를 높여 항균 특성이 우수한 결과를 보였고 특히, Aa의 첨가율이 1.3%일 때 가장 항균 특성이 우수하였다. 그리고 ASTM E2149 규격을 사용한 항균 실험 결과에서 Aa의 첨가율이 1.3%와 Aam의 첨가율이 1.3%인 키토산 유도체는 S. aureus와 E. coli에 대해 99.9%의 균 감소율을 보였다.