Introduction
폴리이미드(PI)는 매우 높은 열안정성, 우수한 내화학성, 높은 기계적 강도를 갖고 있는 고성능 고분자재료로 산업전반에 광범위하게 사용되고 있지만, 대부분의 PI는 너무 견고한 사슬구조로 인해서 일반 유기용매에 대한 용해도가 좋지 못한 단점을 갖고 있다. 이에 우수한 물성을 가진 PI의 고유 물성을 저해시키지 않으면서 고분자사슬 변화를 통해서 가공성을 개선하기 위한 방법이 시도되고 있는데, 예로 방향족 ether 연결고리를 도입한 결과 매우 낮은 내부회전에너지로 인해서 유리전이온도와 용융온도는 낮아졌으며 벌키한 치환체들이 도입된 경우 고분자 사슬의 결정화와 패킹현상을 방지하여 일반 유기용매에 대한 용해도가 크게 증가하였다고 보고되고 있다.1-3
PI와 유사한 헤테로고리 고분자인 방향족 폴리벤즈옥사졸[Polybenzoxazole(PBO)s]은 1998년 Zylon이라는 상품명으로 일본에서 생산된 슈퍼섬유(SF)로 잘 알려져 있는데, 분자구조가 벤젠고리에 oxazole 고리가 있는 단단한 막대 모양이 규칙적인 반복단위로 구성된 고분자로서4열안정성이 매우 뛰어나며 기계적 특 내마모성, 내화학성, 열산화안정성 그리고 난연 특성을 갖고 있다. 이러한 PBOs는 섬유나 필름으로 가공되어 우리 일상생활의 스포츠용품으로부터 고성능이 요구되는 자동차부품, microelectronics, 반도체 부품을 비롯한 우주항공분야의 첨단복합재료에 이르기까지 다양한 분야에 이용되고 있다.5-7이렇게 우수한 물성을 갖은 PBOs지만 너무 단단한 벤즈옥사졸 분자구조의 강직성으로 인해서 대부분의 유기용매에 용해되지 않으며 일부 강산에만 용해되고 용융되기 전에 열분해 되는 특성으로 인해서 가공이 매우 어려운 단점이 있다.8대부분의 PBOs는 가공상의 어려움을 해결하기 위해서 전구체인 poly(hydroxyamide)s(PHA)s를 가공하여 열처리에 의해 PBOs로 전환시키고 있다. PHAs는 PBOs와 유사한 우수한 물성을 가지고 있으며 일반 유기용매에 대한 용매 특성이 우수하다고 평가되고 있다. 하지만 PHAs 역시 방향족 폴리아미드계 고분자로서 용매특성은 일반 고분자에 비해 좋지 않기 때문에 고분자의 구조 변화를 통한 가공성 문제를 풀기 위한 노력을 하고 있다.9,10
본 연구팀은 PBOs의 문제점들을 해결하기 위해 선행연구에서 bis(o-aminophenol)단량체인 3.3′-dihydroxybenzidine과 ether 연결고리에 벌키한 MPEG 단위, dimethlyphenoxy 단위, 비선형의 naphthalene 단위나 quinoxaline 단위를 갖는 단량체들과의 저온용액 중축합이나 직접 중축합법으로 조성별 공중합체를 합성하여 그 결과들을 발표하였다. 이들은 도입된 펜던트 단위 또는 비선형 단위들의 구조변화에 따라 다양한 열적, 기계적 특성 및 용해도에 많은 변화를 보였다.8,10,12,13,18
Fu 등11은 poly(benzobisoxazole)s에 methylene 치환기를 도입한 결과 용해도는 증가된 반면, 열안정성은 심각하게 저하되었으며, ether 연결고리나 sulfone 연결고리 등을 주 사슬에 도입한 경우는 미미한 용해도 향상 결과를 가져왔다고 발표하였고, 주 사슬에 perfluoroisopropyl 그룹을 도입한 결과 극성이 낮은 용매인 m-cresol 이나 THF에도 좋은 용해도 특성을 보였다고 발표하였다.
본 연구에서는 trifluoromethyl 그룹을 갖는 2,2-bis(3-amino-4-hydroxyphenyl) hexafluoropropane(6FD)를 단량체로 사용하여 비선형단위인 2,3-quinoxaline 단위와 2,3-pyridine 단위를 갖는 diacid 단량체들과 직접중축합에 의해서 조성별 공중합체를 합성하였다. 또한 열적고리화 반응을 거친 PBOs의 용해도 특성, 열적특성 및 모폴로지 등을 조사하고자 한다.
Experimental
본 연구에서 사용된 시약은 다음과 같다. 2,2-Bis(3-amino-4-hydroxyphenyl)-hexafluoropropane (6FD, 98%)과 4-fluoro-benzonitrile (99%)은 TCI (Japan)사의 제품을 사용하였고, 2,3-dihydroxy quinoxaline과 2,3-dihydroxy pyridine은 Santa Cruz Biotechnology (USA)사의 제품을 승화 정제하여 사용하였다. CaCl2는 JunseiI (Japan)사에서 구입하여 24시간 동안 80°C의 진공오븐에서 건조하여 사용하였고, 용매로 사용된 N,N′-dimethylformamide (DMF, 99%)와 N-methyl-2-pyrroli-done (NMP, 99%)는 JUNSEI사의 제품을 사용하였으며 건조된 MgSO4와 48시간 동안 교반한 후에 감압 증류하여 사용하였다.
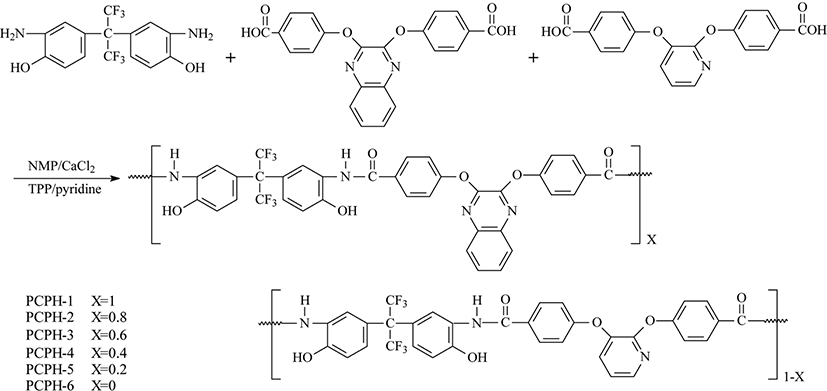
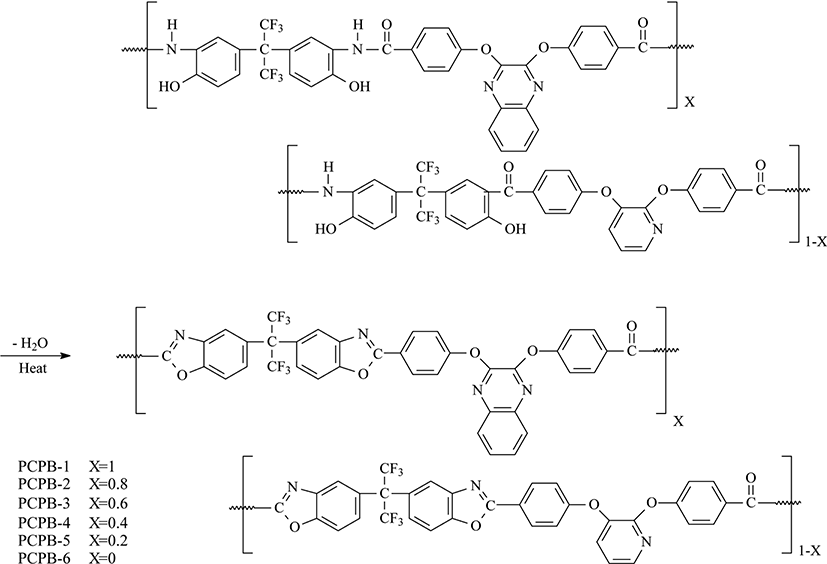
본 연구에서 사용된 단위체인 4,4′-(2,3-quinoxalinedioxy)di-benzoic aicd의 합성은 Jo12의 방법을 따랐으며 4,4′-(2,3-pyridinedioxy)dibenzoic acid의 합성은 Park13의 방법을 수정하여 합성하였다. 본 연구에서 중합된 PHAs은 Park13의 방법을 참고하되 수정하여 중합하였고 그 경로를 Scheme 1에 보였다. 또한 열적고리화 반응을 거쳐 제조된 PBOs의 합성 경로는 Scheme 2에 보였다. PHAs는 주 사슬에 pyridine과 quinoxaline 단위의 몰 조성 비율을 달리하여 중합 및 공중합체를 합성 하였으며 편의상 pyridine 단위와 quinoxaline 단위만을 갖는 중합체를 PCPH-1, PCPH-6라 하였고, pyridine/quinoxaline 단위의 조성비가 0.8/0.2, 0.6/0.4, 0.4/0.6, 0.2/0.8인 공중합체의 경우 PCPH-2~PCPH-5로 표현 하였다. 대표로 PCPH-5의 합성경로를 보였다. Ar 가스 분위기의 3구 반응기에 CaCl20.164 g (1.474 mmol)을 넣고, NMP 1.5 mL와 pyridine 0.16 mL를 첨가하여 100℃에서 녹인 후 5분간 저어주었다. 이 반응 혼합물에 4,4′-(2,3-pyridinedioxy)dibenzoic acid 0.040 g (0.114 mmol)과 4,4′-(2,3-quinoxalinedioxy)di-benzoic acid 0.183 g (0.453 mmol)를 첨가하여 투명하게 녹인 다음, 2,2-Bis(3-amino-4-hydroxyphenyl)-hexafluoropropane 0.210 g (0.573 mmol)를 첨가하여 15분간 약하게 저어주었다. 반응 온도를 110℃로 올리고 triphenyl phosphite (TPP) 0.5 mL를 첨가한 후, 약 2시간 30분간 반응 시킨 다음, 메탄올에 반응 혼합물을 침전시켜 옅은 노란색의 중합체를 얻었다. 회수된 중합체는 증류수와 뜨거운 MeOH로 수 회 세척하여 불순물들을 제거하였다. 중합체들은 진공건조기(40℃)에서 약 20시간 동안 건조시켰고 얻은 생성물의 수득률은 68% 였다. 또한 합성된 PHAs는 모두 열적고리화 반응에 의해 PBOs로 전환이 되었으며 이들 PBOs를 PCPB-1~PCPB-6로 각각 표현 하였다.
본 연구에서 합성된 PHAs는 1H-NMR spectrometer (JNM-LA300, JEOL Co.)와 FT-IR spectrometer (8601PC, Shimadzu Co.)를 사용해서 합성을 확인하였다. 열적특성 조사는 DSC (DSC 2010, TA)를 사용해서 승온 속도 10℃/min로 50~450℃ 온도범위까지 질소 기류하에서 측정되었으며 이때 열적고리화 반응에 해당하는 흡열피크와 패턴을 관찰하였다. 또한 TGA (TGA 2050. TA)을 사용하여 질소 기류 하에서 승온 속도 10℃/min로 50~900℃까지 측정하여 열적 고리화 반응에 따른 중량감소를 비롯한 최대무게손실온도 그리고 잔류량(Char) 생성에 관한 조사를 하였다. Xper Pro 회절분석기 (PANalytical Co.)를 사용하여 2.5~50°(2θ)의 범위를 스캔하여 X-선 회절곡선들을 관찰하였다.
Results and Discussion
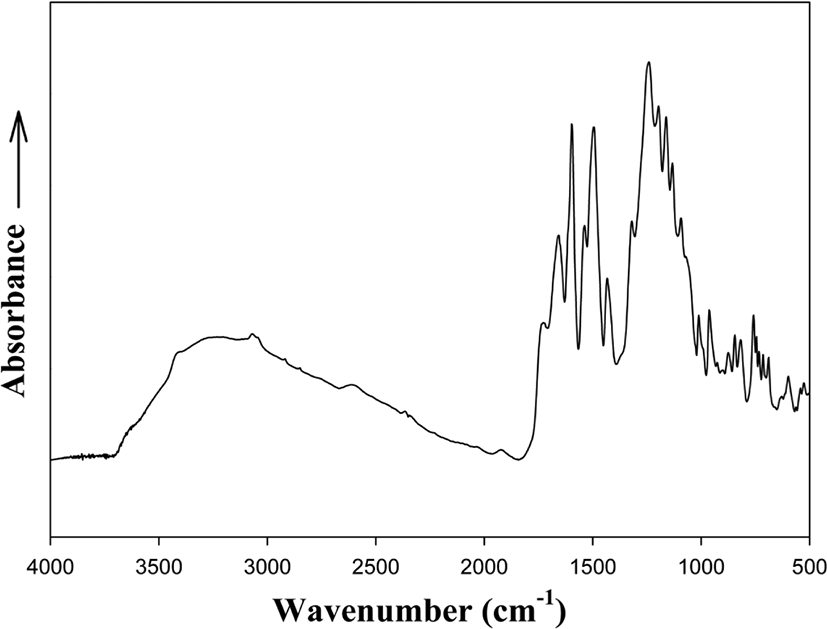
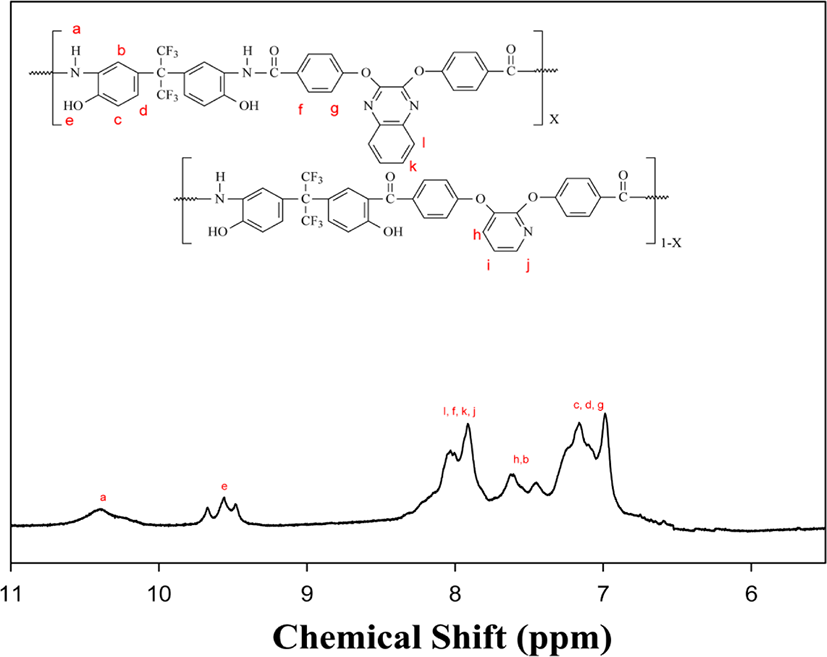
본 연구에서 합성된 중합 및 공중합체들은 FT-IR과 1H-NMR (JNM-LA300)을 사용하여 합성을 확인하였다. Figure 1과 2에 여러 중합체들 중 PCPH-5의 FT-IR 스펙트럼을 대표로 보였다. 3000~3500 cm−1 (O-H, N-H stretching), 1657 cm−1 (C=O stretching), 1597 cm−1 (C=N stretching), 1239 cm−1 (C-O-C stretching), 1161 cm−1 (CF3-C-CF3 stretching) 밴드를 확인하였으며 Figure 2의 1H-NMR 스펙트럼에서는 δ=9.46~10.4 ppm (-NH, -OH), 7.79~8.31 ppm (l, f, j, k), 7.35~7.65 ppm (h, b), 6.84~7.31 ppm (c, d, g)에서 각 프로톤들에 해당되는 피크들을 확인 할 수 있었고, 각 피크들이 가지는 수소의 면적 비가 이론값과 일치함으로써 공중합체가 합성되었다는 것을 확인할 수 있었다.
Table 1에 PHAs의 대수점도와 제조된 필름상태를 나타내었다. 점도는 중합체를 DMAc에 0.1 g/dL의 농도로 용해시켜 불순물을 거른 다음 35℃ 항온조에서 측정하였다. 대수점도 값들은 0.14~0.35dl/g의 범위의 비교적 낮은 값들을 보였다. 필름 제조는 PHAs 0.5g을 N,N-dimethylacetamide (DMAc) 1.5 mL에 완전히 녹인 다음 유리판(10 × 20 cm)에 도포 후 드라이오븐에 넣어서 60℃에서 2시간 30분 동안 건조시켰다. 이렇게 얻어진 필름들은 잔류 용매제거를 위해서 에탄올에 24시간 방치하였으며 이후, 실온에서 24시간 건조하여 투명한 밝은 노란색과 진한 노란색을 띄는 brittle한 필름을 최종적으로 얻었다. PHAs 필름은 주 사슬에 pyridine 단위의 조성비가 커질수록 밝은 노란색을 띄는 반면에 quinoxaline 단위의 조성비가 커질수록 색깔이 진해지는 노란색을 띄는 필름이 제조되었음을 알 수 있었다. 그러나 본 연구와 같은 단량체에 3,3'-dihydroxy benzidine과 합성된 중합체들에서 만들어진 필름 보다는 훨씬 옅은 색깔을 보여 주었다. 이는 CF3와 같은 전기음성도가 강한 그룹을 도입함으로써 π 전자의 이동을 제한하여 공명효과를 낮추는 방법을 사용함으로써 전하전이복합화를 줄이기 때문으로 생각된다.14
그러나 제조된 모든 PHAs 필름들의 상태가 먼저 언급한 바와 같이 brittle하여 필름들에 대한 기계적 성질이나 난연특성들을 조사할 정도의 상태를 보여 주지 못해 이들 특성들은 조사하지 못하였다. 이는 무엇보다도 낮은 대수점도 값들에서 암시 하듯이 낮은 분자량 때문으로 생각된다. 이처럼 분자량이 낮은 이유는 전자를 끄는 6F의 존재에 의해서 야기된 fluorine의 낮은 친핵성 때문으로 생각된다.15Table 2는 합성된 PHAs와 PBOs의 용해도 특성을 보였다. PHAs의 경우 aprotic 용매인 DMAc, DMSO, NMP, DMF 등을 비롯해서 극성이 낮은 용매인 pyridine에서도 금속염(LiCl) 첨가 없이 실온에서 잘 용해되었으며 THF에서는 부분적으로 용해되는 특성을 보였다. Table 2에서 보여준 PHAs의 용해도 특성은 일반적인 방향족 중합체들의 용해도보다 매우 우수함을 보여 주었는데, 이는 PHAs 설계 시 주 사슬의 선형성을 깨트리기 위해 도입된 벌키한 quinoxaline 단위와 pyridine 단위 그리고 유연한 ether 단위가 도입되어 있기 때문으로 생각되며, 이러한 결과는 선행 연구에서 이미 입증한바 있다.13 본 연구팀은 선행 연구에서 방향족 bis(o-aminophenol) 단량체로 3,3'-di-hydroxybenzidine을 사용하고 나머지 구조는 본 연구와 동일한 PHAs를 합성하여 발표한 결과 내용에서도 본 연구 결과와 같이 매우 용해도가 향상되었음을 발표하였다. 그러나 일부 중합체들의 경우 극성이 낮은 pyridine에서는 부분적으로만 용해되었으며, 용매 중 가장 낮은 극성의 THF에서는 quinoxaline 단위 조성비가 큰 PHAs만 부분적으로 용해되고 quinoxaline 단위 조성비가 큰 PHAs 경우는 전혀 용해되지 않음을 보였다. 하지만 본 연구에서 합성된 중합체들은 극성이 낮은 pyridine에서 완전히 용해되었고, THF에서 조차도 모든 중합체가 부분적으로 용해되는 특성을 보임으로써 본 연구에서 합성된 중합체의 용해도가 선행 연구 중합체에 비해서 크게 향상되었다는 사실을 확인하였다. 이는 선행 연구에서 사용하였던 3,3'-dihydroxybenzidine과 달리 bis(o-aminophenol)단량체로 사용된 6FD에는 두 개의 벌키한 trifluoromethyl 그룹이 존재하는데 이와 같이 fluorine을 함유한 치환체들은 fluorine 원자들의 강한 전기음성도로 인해서 큰 극성을 유발하기 때문에 non-fluorine 치환체들에 비해서 일반 유기용매 뿐 아니라 극성이 작은 용매에서도 좋은 용해도 특성을 보였으며, 또한 이러한 벌키그룹들이 전 중합체의 비 선형성을 향상 시키고, 주 사슬간의 인력과 패킹현상을 감소시킴에 따라서 용매 침투가 더 용이해졌기 때문으로 생각된다.1,6,16
반면에 전기로에서 열처리과정을 거쳐서 제조된 PBOs의 경우 PHAs에서 보였던 유기용매들에 대한 우수한 용매특성을 전혀 보이지 못했고 강산인 황산에서만 부분적으로 용해되었는데 시간이 지나면서 변색이 일어나며 분해되는 특성을 보였다. 선행 연구결과에서도 열처리를 거친 PBOs의 경우 용해도가 전혀 향상되지 않은 동일한 결과를 보였는데, 본 연구에서는 유연하고 부피가 큰 6FD 치환기가 도입된 PHAs가 설계되었음에도 기대와는 다른 결과를 보였음을 알 수 있다. 이러한 원인으로는 PBOs의 경우 열처리에 의한 열적고리화 반응을 거치면서 형성된 매우 강직한 oxazole ring과 사슬 간의 패킹현상 증가 그리고 열처리과정에서 발생되는 사슬간의 가교반응 등이 원인이 되어 용해도 향상이 기대에 미치지 못했다고 사료된다.13 다시 말해서 6FD에 존재하는 trifluoromethyl 그룹이 PBO의 용해도 향상에 전혀 기여를 못하였음을 보여 주었다. 앞으로 이러한 부분은 PBO중합체의 용해도 향상을 위해서 열처리 온도, 속도 및 시간 등을 고려하여 추가적인 연구가 필요하다.10
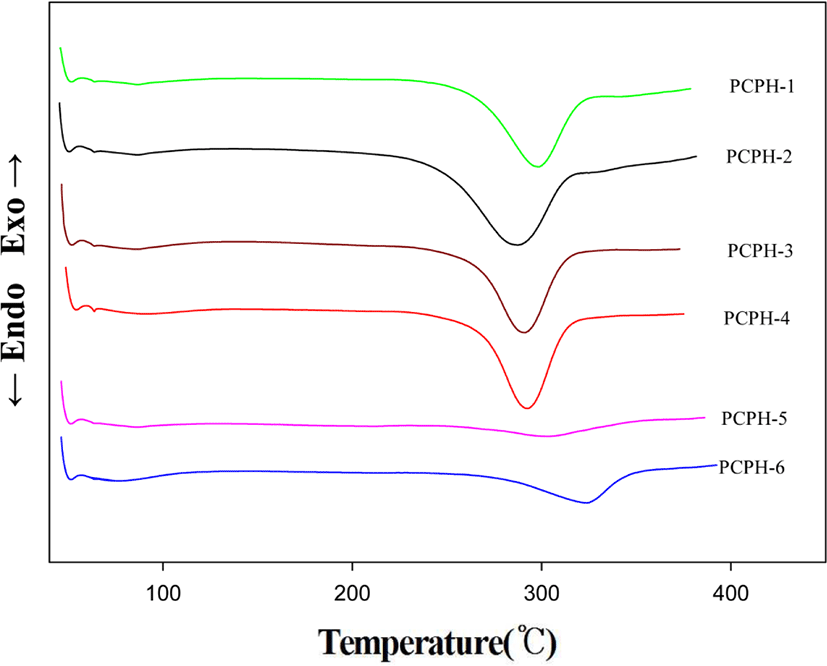
Figure 3에는 PHAs의 DSC 1차 열곡선들을 보였고 Table 3에 그 결과를 나타내었다. DSC 열곡선에서는 220~350℃ 범위에서 큰 흡열피크가 형성되었음을 관찰할 수 있다. 이 흡열구간에서는 PHAs가 열적고리화 반응을 통해 주골격에 있는 amide 결합과 dihydroxy 그룹들이 반응하여 oxazole ring이 형성되면서 PBOs로 전환될 때 에너지를 흡수하는 구간으로 동시에 물 분자를 방출한다.17
흡열구간의 피크 온도(Tp)는 287~325℃의 범위에서 관찰되었다. 이들 값들을 보면 완전한 경향성을 보이지는 않았지만 pyridine 단위의 조성이 높아질수록 피크 온도가 높아짐을 보였다. 엔탈피변화 값(ΔH)은 18~78 J/g의 범위를 보였다. 중합체들의 값들을 비교해보면 quinoxaline 단위가 8/2, 6/4, 4/6, 2/8로 증가함에 따라 ΔH가 18, 67, 71, 78 J/g으로 증가하는 경향성을 보였다. 이는 pyridine 단위보다 bulky하고 반응에 대한 장애가 더 클 것으로 예상되는 quinoxaline 단위를 포함한 PHA의 경우 열적고리화 반응에서 더 많은 에너지를 필요로 했기 때문이라 생각된다. 그러나 이러한 예측에 대해서는 더 많은 연구가 필요하다. PHAs 가 PBOs로 전환 되었는지를 확인하기 위해서 통상 FT-IR를 이용한다. 전기로에서 열처리를 거쳐 PBO로 전환시킨 후, 측정한 FT-IR 스펙트럼에서는 PHAs 고유특성피크들이 모두 사라짐을 알 수 있었다. 3000 ~3500 cm−1에서 O-H, N-H 피크와 1657 cm−1에서 C=O 피크를 확인했지만, 열처리 후에는 이러한 피크들이 모두 사라지고 PBO의 특성 피크인 1730 cm−1에서 oxazole C=N 피크와 1460 cm−1에서 C-N 피크들을 확인함으로써 모두 PBO 전환되었음을 확인하였다.
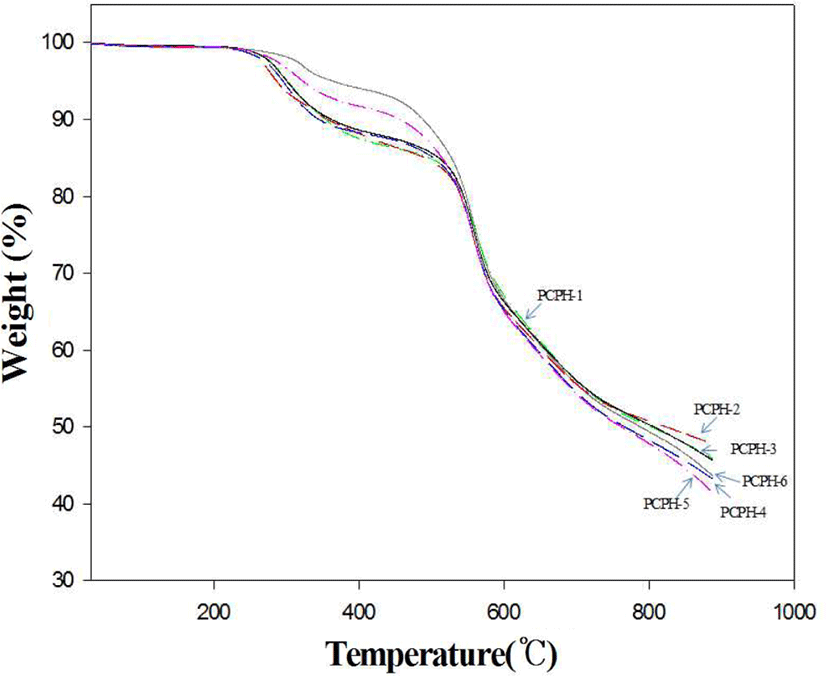
Figure 4에는 TGA를 이용해 PHAs의 열분해 곡선들을 보였고, Table 3에 그 결과들을 나타내었다. PHAs에 대한 TGA 열분해 곡선의 경우 많은 연구에서 발표한 바와 같이 2단계의 열분해 곡선을 보인다.10,17 본 연구의 경우에서도 2단계의 명확한 분해곡선을 보여 주었는데, 첫 번째 열분해 곡선은 약 220~350℃ 구간 사이에서 중량손실이 관찰되었다. 이 구간에서는 PHAs가 고리화 반응에 의해서 PBOs로 전환되면서 물이 빠져나오는 구간에 해당되는 것으로 앞선 DSC 열곡선 분석 결과와도 거의 일치함을 알 수 있다. 두 번째 열분해 곡선은 대략 400℃ 이후에서 중량이 서서히 감소됨을 관찰할 수 있는데, 이 구간부터는 PHAs가 PBOs로 거의 전환된 이후 고분자들의 주 사슬들이 분해에 따른 중량감소구간에 해당된다. 각 중합체들의 중량감소 구간이 약간의 차이는 있지만 약 550℃ 이후에서 급격하게 주 사슬이 분해되는 것을 알 수 있는데 이들은 DTG 곡선을 통해서 확인한 최대중량손실 온도(Tdmax) 값들을 통해서 알 수 있다. 참고로 이 값들은 고분자 재료들의 내열 및 난연 특성과도 밀접한 관계를 갖는다.18 내열 및 난연 특성들이 좋은 고분자들은 급격하게 주 사슬들이 분해되기 보다는 완만한 경사의 열분해 곡선을 보이며 대체로 높은 Tdmax 값들을 유지한다. 본 연구에서 보여주는 Tdmax 값들은 대략 557~560℃의 범위를 보여주는데 선행 연구인 park13의 경우에는 628~638℃를 보여 이들 값들로만 비교하면 전자가 후자보다 낮은 내열 및 난연 특성을 보임을 알 수 있다. PHAs의 TGA 1 단계 열분해 곡선에서는 열적고리화 반응 시 생성되는 이론적 물손실량을 실제 값과 비교해 보는 것은 중요하다. 공중합체 PCPH-2~5의 실제 값들은 5.23, 5.15, 5.08, 그리고 5.10 wt.%를 보였지만 이론값들은 5.21, 5.13, 5.06 그리고 4.99 wt.% 값을 보여서 실제 값과 이론값의 물 손실량이 거의 일치함을 알 수 있었다. 이러한 결과는 중합 후 잔류해 있을 수 있는 용매나 미 반응 물질 등이 중합 후 처리과정을 통해 충분히 제거된 것으로 생각 할 수 있다. 고분자 재료에 반응 용매나 미 반응 물질 등 불순물이 남아 있게 되면 고분자의 물성에 많은 영향을 미친다는 것은 널리 알려진 사실이다.13 또한 공중합체의 이론 물 손실량은 quinoxaline 단위 조성이 증가할수록 적어지는데 이는 quinoxaline 단위가 pyridine 단위보다 분자량이 커서 상대적으로 물 손실 양은 적기 때문이다. Table 3의 TGA 열분해곡선 분석결과에 초기분해온도로 선택된 10% 중량손실온도 값은 345~489℃의 범위를 보였고, 공중합체들 중 pyridine 단위의 조성이 커질수록 10% 중량손실온도 값들이 345~456℃로 점점 더 증가함을 알 수 있었다. 900℃까지 측정된 char 잔류량 값은 공중합체 PCPH-2~5의 경우 quinoxaline 단위의 조성이 커질수록 char 값이 41.4, 43.2, 45.6, 47.7%로 증가하는 경향성을 보였는데, 이는 화합물들의 구조에서 알 수 있듯이 pyridine 단위보다 quinoxaline 단위의 방향족고리가 더 많기 때문인 것으로 추측할 수 있다.
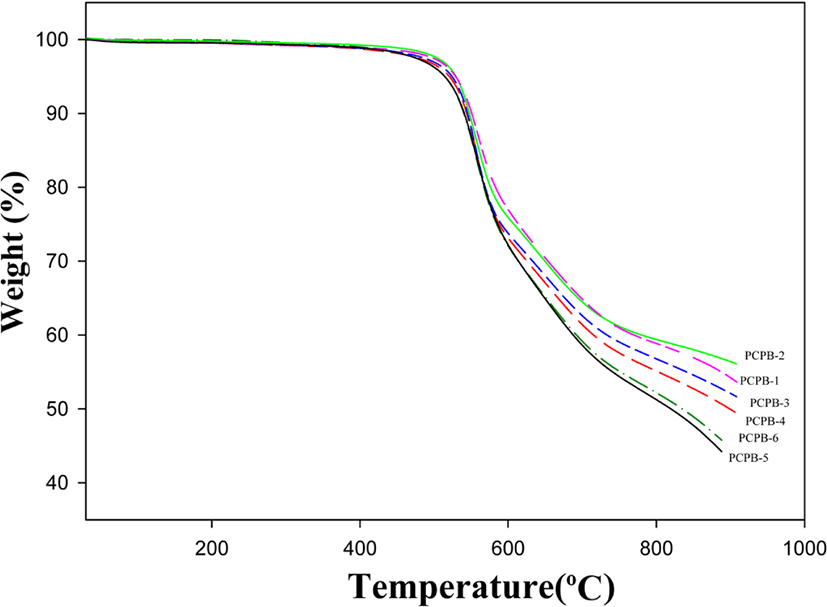
Figure 5 및 Table 3에 PBOs의 TGA 열분해 곡선 및 그 결과들을 보였다. 모든 PHAs는 앞서 분석된 DSC 열분석 결과와 TGA 열분해곡선의 분석 자료를 근거로 전기로에서 열처리 과정을 통해서 PBOs로 전환시켰다. PBOs의 TGA 열분해 곡선을 관찰해보면 앞서 관찰한 TGA 열분해 곡선에서 보였던 2단계의 분해 곡선을 보이지 않고 1단계의 분해 곡선만을 보이고 있음을 알 수 있다. 이러한 결과는 열처리과정을 거치면서 모든 PHAs가 PBOs 전환되었음을 예측할 수 있다. TGA에서 보여지는 PBOs의 열분해 곡선들은 대략 500℃ 근처의 온도에서부터 서서히 주 사슬이 분해되는 경향을 보이다가 약 580℃ 이후부터 급격한 중량손실의 열분해 곡선을 보이고 있다. PBOs의 10% 중량손실 온도 값들 중 공중합체 PCPB-2~5는 540~548℃ 범위를 보였는데 quinoxaline 단위 조성이 가장 큰 PCPB-2는 PCPB-3,4,5에 비해서 각각 3℃, 4℃ 그리고 8℃ 높은 값을 보여 예상대로 quinoxaline 단위의 조성에 따라 증가하는 결과를 보여 주었다. 그러나 앞에서 언급된 PHAs의 10% 중량손실 온도 값과는 반대의 경향성을 보이고 있음을 알 수 있다. 이러한 결과는 여러 요인들로 설명 할 수 있다. PHAs의 경우는 앞에서 언급한 바와 같이 일반 고분자와 달리 5~10% 중량손실온도 과정에서 열적고리화 반응의 부산물인 물과 기타 용매 등 불순물의 증발로 고분자의 초기분해로 인한 중량감소가 동시에 일어나기 때문에 실질적인 초기분해온도 값을 결정하기는 쉽지 않다. 또한 화합물에 함유된 용매 등 불순물에 의해서 고분자 재료의 초기분해온도는 감소 할 수 있다. 이러한 요인들에 의해서 PHAs의 경우는 PBOs와 달리 pyridine 단위 함량이 증가함에 따라서 10% 중량손실온도 값들이 증가함을 보인 것으로 생각된다. 그러나 PBOs의 경우 적절한 온도의 전기로에서 열처리과정을 통해 PHAs가 PBO로 전환되면서 동시에 잔류할 수 있는 용매 등이 제거되기 때문에 앞에서 언급된 우려하는 일은 없을 것으로 사료된다. 따라서 예상대로 quinoxaline 단위를 갖는 PBOs가 더 좋은 열적특성을 보인 것이라 생각된다. PBOs의 최대중량손실 온도는 560~557℃로 PHAs와 거의 동일한 온도구간을 보였으며 pyridine 단위와 quinoxaline 단위 조성에 따른 특별한 경향성은 보이지 않았다. PBOs의 공중합체 PCPB-2~5의 char 값은 45.8~56.7% 값을 보였으며 이 역시 quinoxaline 단위의 조성이 커질수록 char 값이 커지는 경향성을 보였다. 이들 PBOs 에 대한 TGA 결과를 park 의 연구 결과와 본 연구 결과를 비교해 보면 10% 중량손실 온도는, 전자는 605~628℃, 후자는 537~551℃이고, 최대중량손실 온도는 전자는 621~653℃, 후자는 556~560℃이며, 900℃ 잔유량은 전자는 70.5~72.4% 후자는 45.8~56.7%로 모든 값들에서 park13의 연구 결과가 본 연구 결과보다 우수함을 알 수 있다. 이러한 결과는 본 연구에서 사용된 6FD에 포함된 trifluoromethyl 그룹들이 고분자들의 용해도 향상에서는 많은 도움을 주었지만, tri-fluoromethyl 그룹 특성상 조기 열분해로 인하여 열적성질들은 보다 더 저하된 것으로 추측된다.19
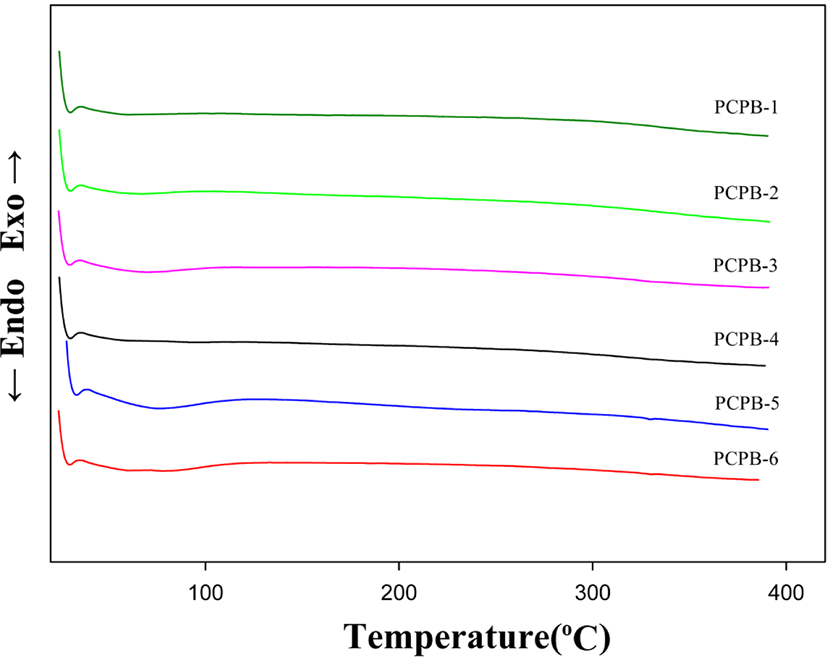
Figure 6에는 DSC 2차 열곡선 그래프를 나타내었다. DSC 1차 열곡선 분석결과를 기준으로 전기로에서 열처리하여 PBOs로 전환시켰다. DSC 2차 열곡선에서는 1차 열곡선에서 보였던 흡열피크가 모두 사라져 PHAs가 열적고리화 반응에 의해서 PBOs로 전환되었음을 확인할 수 있다. 그러나 이들 열곡선으로부터 모든 조성에서 유리전이온도는 발견하지 못하였다.
PHAs의 모폴로지 관찰은 액체질소에서 파단시킨 필름의 파단면에 대해 SEM을 이용하여 관찰하였다. PHAs 필름은 연하고 밝은 색의 투명한 매우 brittle한 필름이 제조되었다. Figure 7에는 공중합체 중 pyridine 단위가 가장 큰 PCPH-5의 사진 (a)를 확대한 사진 (b)를 보였다. 사진 (a)에서는 약간 거친 파단면에 하얀색의 좁쌀 같은 많은 돌기들이 확인하였다. Quinoxaline 단위가 가장 큰 PCPH-2의 사진 (c)와 (d)에서도 역시 PCPH-5와 같이 파단면에서 흰색의 좁쌀과 같은 수많은 돌기들을 관찰하였는데 사진 (c)의 경우 사진 (a)에서 보여진 하얀 돌기들보다 크게 형성이 되었으며 확대된 사진 (d)에서 이러한 사실을 확인할 수 있었다. PBOs의 경우 열처리과정에서 필름이 너무 brittle 해져서 SEM은 관찰하지 못했다.
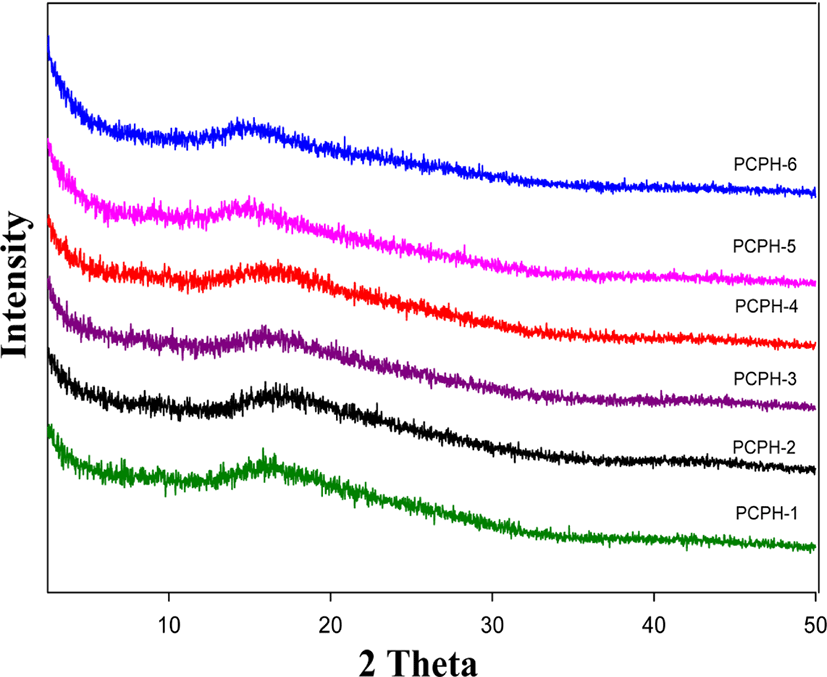
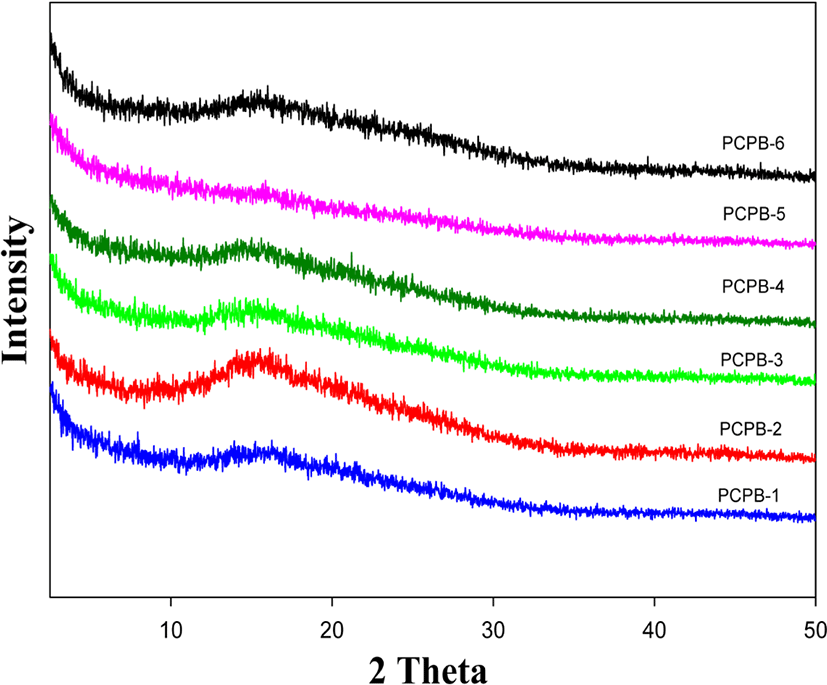
Figure 8와 9에 PHAs와 PBOs의 X-ray 회절 분석을 이용해 결정성을 알아보고자 2θ=2.5°~50° 스캔한 PHAs와 PBOs의 회절패턴 결과를 보였다. PHAs와 PBOs의 X-ray 회절곡선들은 모두 결정성의 특정피크가 없는 비결정형의 브로드한 무정형의 halo 타입의 회절패턴을 보이고 있다. 이러한 이유는 앞서 설명하였지만 유연하고 벌키한 trifluoromethyl 그룹이 사슬간의 상호작용을 방해하여 패킹현상을 감소시켰고 벌키하고 비선형의 quinoxaline과 pyridine 단위 또한 사슬간의 규칙성을 방해했기 때문으로 생각된다. PHAs와 PBOs의 2θ 값을 비교해보면 공중합체 PCPH-2~5의 2θ 값이 14.73, 16.42, 16.21, 16.89°로 quinoxaline 단위의 함량이 감소함에 따라서 광각 쪽으로 이동하는 경향을 보였고, PCPB-2~5의 2θ 값은 15.55, 14.96, 14.96, 15.85°로 전체적으로 PCPB-2를 제외하고는 2θ 값이 PHAs 보다 소각 쪽으로 약간씩 이동하였음을 보였다. 이러한 결과는 PHAs 사슬들이 PBOs로 전환되는 열처리를 거치면서, 불규칙적이었던 사슬들이 보다 더 규칙성을 갖게 되면서 사슬 층간의 거리가 증가했기 때문으로 생각된다. 이러한 무정형의 회절패턴들은 유기용매에 대해서 좋은 용해도 특성을 보인다고 알려져 있으며,5,6 앞의 용해도 조사에서도 용매특성이 크게 증가했음을 확인할 수 있었다.
Conclusions
본 연구에서는 bulky하고 유연한 hexafluoroisopropylidene 단위와 비선형의 pyridine과 quinoxaline 단위가 조성별로 도입된 PHAs를 직접중축합법으로 합성하였으며 또한 열처 리를 통해서 전환된 PBOs의 특성조사를 한 결과는 다음과 같다.
-
PHAs의 고유점도는 0.17~0.35 dL/g 범위의 비교적 낮은 값을 보였다. 또한 연한 밝은 노란색부터 진한 노란색의 매우 brittle한 필름이 제조되었다.
-
PHAs는 DMAc, DMSO, NMP 등의 극성용매와 상대적으로 극성이 낮은 pryidine에도 실온에서 완전히 용해되었을 뿐 아니라 THF에서도 금속염(LiCl) 첨가나 가열 없이 부분적으로 용해되는 우수한 용매특성을 보였다. 하지만 PBOs의 경우는 황산에만 부분적으로 용해되었다.
-
DSC 1차 열곡선에서는 열적고리화 현상에 따른 큰 흡열피크가 관찰되었고, 공중합체(PCPH-2~5)들의 흡열엔탈피는 quinoxaline 단위 조성이 커질수록 18~78 J/g 비례하여 증가하였다. TGA 열분해곡선에서는 PBOs의 10% 중량감소구간 범위는 PCPB-2~5의 경우 540~548℃였으며 quinoxaline 단위 조성비 클수록 비례하여 높은 중량손실온도 값을 보였다. PBOs의 char 값은 45.8~56.7%로 비교적 높은 값들을 보였다.
-
X-ray 회절곡선 분석 결과에서는 PHAs 와 PBOs 모두 무정형의 할로우 타입 회절곡선이 관찰되었다. PHAs 경우 벌키한 quinoxaline 고리의 조성이 클수록 2θ 값이 소각쪽으로 이동하는 경향성을 보였고, 열처리 후의 PBOs 역시 PHAs와 비교했을 때 소각 쪽으로 이동하는 경향성을 보여 주었다.