Introduction
복합형 액정고분자(Combined main-chain/side-chain liquid crystalline polymers, MCSCLCPs)는 주사슬과 곁사슬 모두에 메소젠기를 가지는 액정고분자로써, 주사슬 액정고분자의 기계적 물성과 곁사슬 액정고분자의 액정 안정성 등의 특성이 함께 작용하여 넓은 액정온도구간을 갖는 고성능, 고기능성의 재료로서 다양한 분야에서의 활용성이 기대된다. 복합형 액정고분자에 대한 연구로써 기초적인 연구는 주로 주사슬과 곁사슬의 구조와 성질의 상관성을 규명하는 것으로 주사슬의 경우, 강직성이나 유연성에 대하여, 곁사슬의 경우, 메소젠기를 주사슬에 연결시키는 유연격자의 종류와 역할에 대한 것 등을 들 수 있다. 또한, 응용연구로는 주사슬이나 곁사슬에 광감성 구조나 카이랄 구조와 같은 기능성 작용기를 도입하여 콜레스테릭 또는 카이랄 스멕틱 액정고분자와 같은 광 기능성 액정고분자를 이용하는 연구들이 진행되고 있다.1-5
특히, 분자내에 카이랄 구조를 갖는 카이랄 네마틱, 카이랄 스멕틱 액정물질들은 다양한 광학적 특성을 나타내며, 이들 중의 하나로써 외부로부터 빛, 열, 전기, 압력, pH 등, 다양한 자극에 의해 변색 현상을 나타낼 수 있기 때문에 여러 분야에서 활용되고 있다.6-8 콜레스테릭 액정은 카이랄 구조를 갖는 액정 분자 층들이 나선형으로 쌓여 있으며, 이 나선의 주기인 피치가 외부자극에 의해 조절되면 특정 파장의 빛을 반사하게 되어 변색 현상을 나타내게 된다. 이러한 현상을 이용하여 콜레스테릭 액정은 섬유, 필름, 페인트 등으로 가공되고 온도표시소자, 디자인 분야 등에 널리 활용되어지고 있다.9-12
또한, 광기능성 소재로써 많은 관심을 받고 있는 아조벤젠은 적절한 파장의 빛에 의하여 trans-cis 광이성질화 현상을 나타낸다. 바닥상태인 trans 아조벤젠은 쌍극자 모멘트 0.5D, 벤젠고리간의 길이 9.0 Å인 선형인데 반해, 파장 365 nm의 자외선에 의해 생성되는 cis 이성질체는 쌍극자 모멘트 3.0D, 지름 5.5 Å 정도의 원형이다.13 따라서, 아조벤젠기를 포함하는 액정화합물은 빛이나 열 등의 외부자극에 의해 광 응답 특성을 나타내기 때문에 광 스위치 소자, 광학 정보 저장 장치, 스마트 섬유 등 다양한 광학 분야에서의 응용을 위하여 연구들이 진행되고 있다.14-18
본 연구에서는 다양한 분야에서 활용되어질 수 있는 고분자 광기능성 소재를 개발하기 위한 연구의 일환으로 고분자 주사슬에는 광감성 작용기인 아조벤젠기를, 곁사슬에는 콜레스테릭 액정 유도기인 콜레스테릴기와 아조벤젠기가 다양한 조성비를 갖도록 설계된 복합형 액정고분자를 합성하고 이들의 특성을 조사하였다.
Experimental
본 연구에서 사용된 시약으로 4-아미노페놀, 페놀 1,6-헥세인다이올은 Aldrich 사 제품을 사용하였으며, 고분자의 합성에 사용된 저분자 화합물인 2,5-Bis(6-(4,4'-cyanoazobenzene)-hexyloxy)terephthalic acid와 2,5-Bis(6-(cholesteryloxy)hexyloxy)terephthalic acid는 본 연구진에 의해 준비되어 있던 것을 사용하였다. 합성 시 중축합 촉매로 사용된 피리딘과 염화티오닐은 각각의 정제방법19에 따라 정제 후 사용하였다.
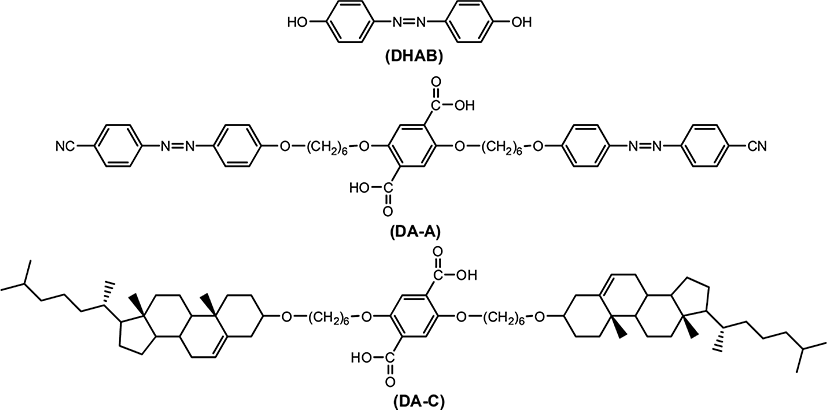
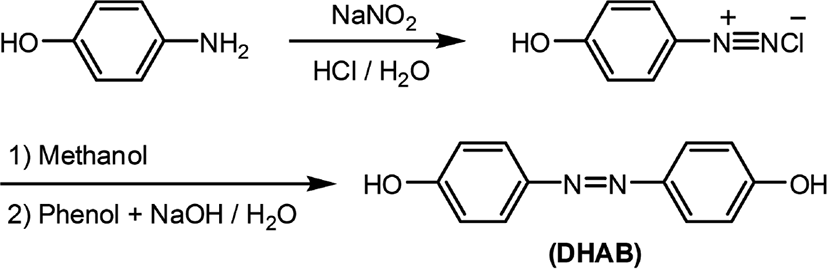
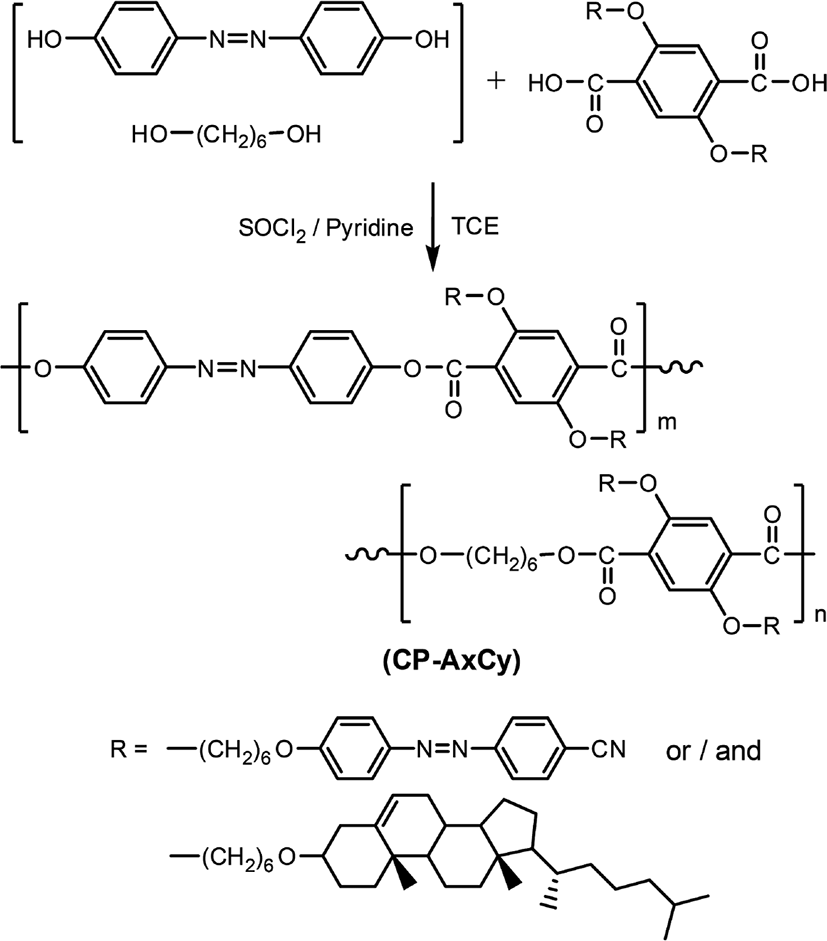
Figure 1과 Table 1에는 복합형 액정고분자의 합성에 사용된 단위체들의 구조 및 일반적인 성질을 나타내었다. 복합형 액정고분자의 주사슬의 메소젠 단위체로 사용된 화합물인 4,4'-Dihydroxyazobenzene은 DHAB로 명명하였으며 Figure 2에 합성 반응식[20]을 나타내었다. 곁사슬의 메소젠기 단위체로 사용된 아조벤젠기를 갖는 화합물 2,5-Bis(6-(4,4'-cyanoazobenzene)hexyloxy)terephthalic acid는 DA-A로, 콜레스테릴기를 갖는 화합물 2,5-Bis(6-(cholesteryloxy)hexyloxy)terephthalic acid는 DA-C로 명명하였다. 이들로부터 합성된 복합형 액정고분자는 CP-AxCy의 형식으로 명명하였으며, 여기에서 A와 C는 아조벤젠 화합물과 콜레스테릴 화합물을, x와 y는 중합에 사용된 이들의 조성비를 각각 나타내었다. Figure 3에는 액정고분자의 합성반응식을, Table 2에는 고분자의 합성에 사용된 단위체의 조성과 수율을 나타내었다. 고분자들의 합성은 모두 직접중축합21 방법을 이용하였기 때문에 고분자 CP-A5C5의 합성방법을 예를 들어 기술하였다.
| Polymers | 1,6-hexanediol (mol%) | DHAB (mol%) | DA-A (mol%) | DA-C (mol%) | Yield (%) |
|---|---|---|---|---|---|
| CP-A0C10 | 50 | 50 | 0 | 100 | 85 |
| CP-A3C7 | 50 | 50 | 30 | 70 | 78 |
| CP-A5C5 | 50 | 50 | 50 | 50 | 76 |
| CP-A7C3 | 50 | 50 | 70 | 30 | 79 |
| CP-A10C0 | 50 | 50 | 100 | 0 | 87 |
드롭핑 펀넬이 장착된 300 ml 반응기에 4-아미노페놀 5.0 g (4.58 × 10−2 mol)과 3.7% 염산을 넣고 얼음중탕 상에서 반응물의 온도를 0℃로 맞추고 교반시킨다. 다른 용기에 NaNO2 3.16 g (4.58 × 10−2 mol)이 용해되어 있는 수용액 80 ml를 준비하고, 이를 반응기내로 천천히 떨어뜨려 4-하이드록시벤젠다이아조늄 클로라이드를 생성시킨 후 메탄올 80 ml를 넣어준다. 다른 용기에 페놀 4.31 g (4.58 × 10−2 mol)과 NaOH 4.81 g (1.2 × 10−1 mol)을 증류수 40 ml와 함께 넣고 5℃에서 용해시킨 후 이를 반응기내로 천천히 떨어뜨리고 상온에서 2hr 동안 반응시킨다. 반응 후, 반응기내의 메탄올을 감압하여 제거하고 염산과 증류수를 넣고 냉각시켜 고체 생성물을 석출시키고 증류수로 수회 세척하여 건조시킨다. 건조된 생성물을 THF에 용해시키고 n-헥세인으로 고체 생성물을 석출시킨 후 진공건조기에서 건조시킨다. 용융점: 221℃, IR 스펙트럼 (KBr, cm−1): 3359 (OH), 1592 (C=C, Ar), 1451 (N=N), 1H-NMR 스펙트럼(CF3COOD-d, ppm): 8.3 (4H, ArH-N), 7.5 (4H, ArH-O), 2.5 (2H, OH).
100 ml 반응기에 SOCl2 2.00 g (1.70 × 10−2 mol)을 정량하여 넣고 드롭핑 펀넬을 장착한 후, 얼음중탕을 이용하여 반응물의 온도를 0℃로 맞추고 서서히 교반시킨다. 피리딘 5 ml를 드롭핑 펀넬을 이용하여 천천히 가하고 20 min 동안 반응시킨 후 얼음중탕기를 제거한다. 다른 용기에 DA-C 4.0 g (0.35 × 10−2 mol), DA-A 2.9 g (0.35 × 10−2 mol), DHAB 0.8 g (0.35 × 10−2 mol), 1,6-헥세인다이올 0.4 g (0.35 × 10−2 mol)을 정량한 후 피리딘 20 ml와 TCE 50 ml에 용해하고 드롭핑 펀넬을 이용하여 천천히 가하고 80℃에서 24 hr 동안 반응하였다. 반응 후 생성물을 메탄올에 석출시키고 메탄올과 증류수로 수 차례 세척하고 진공건조기에서 건조하였다.
합성된 고분자들의 분석에 이용된 기기와 방법은 다음과 같다. 화합물의 화학구조 분석은 적외선분광기(FT-IR, Perkin Elmer Spectrum 1000)와 1H-핵자기공명분광기(1H-NMR, JEOL JNM-AL 300)를, 열분석은 시차주사열량계(DSC, TA DSC Q20)와 열중량분석기(TGA, TA TGA Q50)를, 액정성 확인은 가열판(Linkam TP 92)이 장착된 편광현미경(POM, Olympus BX41)과 용융점 측정기(Fisher Scientific Co.)를, 광화학적 성질은 UV/Vis 분광기(Optizen 2120 UV Plus)를 이용하였다.
FT-IR 측정은 고체상태의 시료를 KBr 방법을 이용하여 400~4000 cm−1 범위에서 스펙트라를 얻었으며, 1H-NMR의 측정은 용매로써 CF3COOD-d 또는 TCE-d2를 사용하여 실온에서 측정하였다. 합성된 고분자의 용해도는 다양한 용매를 사용하여 30℃에서의 용해도와 가열시의 용해도 여부를 조사하였다. 고분자의 대수점도는 Ubbelohde 모세관 점도계를 이용하여 TCE:p-클로로페놀:페놀이 30:35:35의 무게비율로 혼합된 용매에 고분자들을 0.2 g/dL의 농도 용해하여 30℃의 항온수조에서 측정하였다. DSC 측정은 질소분위기에서 10 ℃/min의 가열과 냉각속도로 수행하였으며, TGA 측정은 질소분위기에서 10℃/min의 속도로 상온에서 800℃까지 수행하였다. 액정성 조사를 위한 액정상 texture 확인은 가열판이 장착된 POM을 이용하여 50배율로 관찰하였으며, 보조수단으로써 용융점 측정기를 이용하여 stiropalescence의 유무와 세기를 관찰하였다. 광화학성 분석은 UV/Vis 분광기를 이용하여 5 × 10−5 M의 농도로 THF 용매에 용해시켜 250~550 nm에서 측정하였다. 자외선/가시광선 조사시간의 따른 이성질화 속도를 측정하기 위하여 시료로부터 10 cm 떨어진 곳에서 365 nm 파장의 UV 조사기를 이용하여 특정시간 동안 조사하였으며, 가시광선은 160 lm 밝기의 일반 휴대용 전등을 이용하여 20 cm 떨어진 곳에서 특정시간 동안 조사한 후 측정하였다.
Results and Discussion
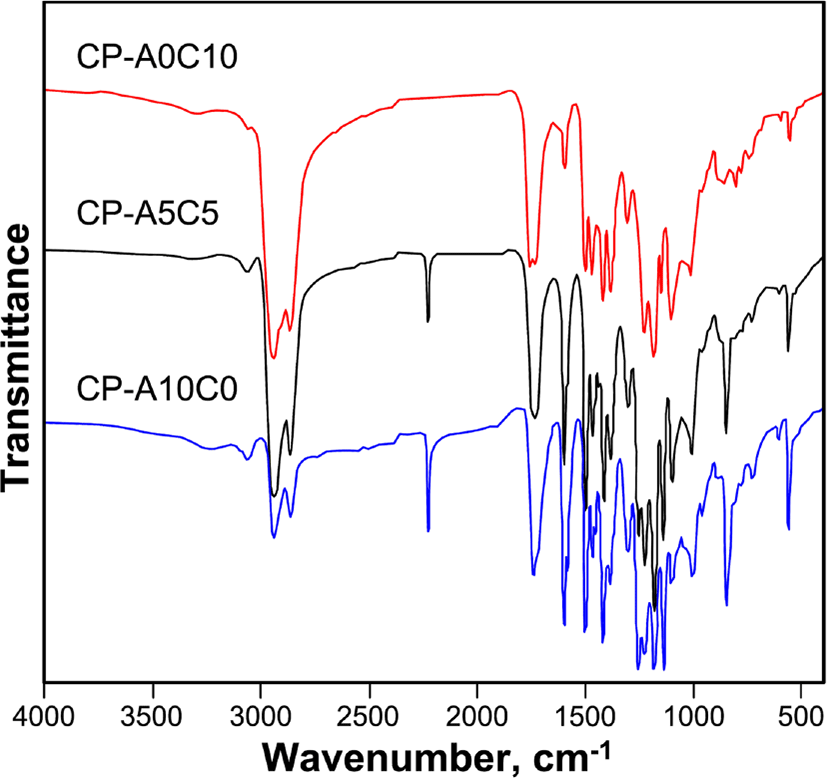
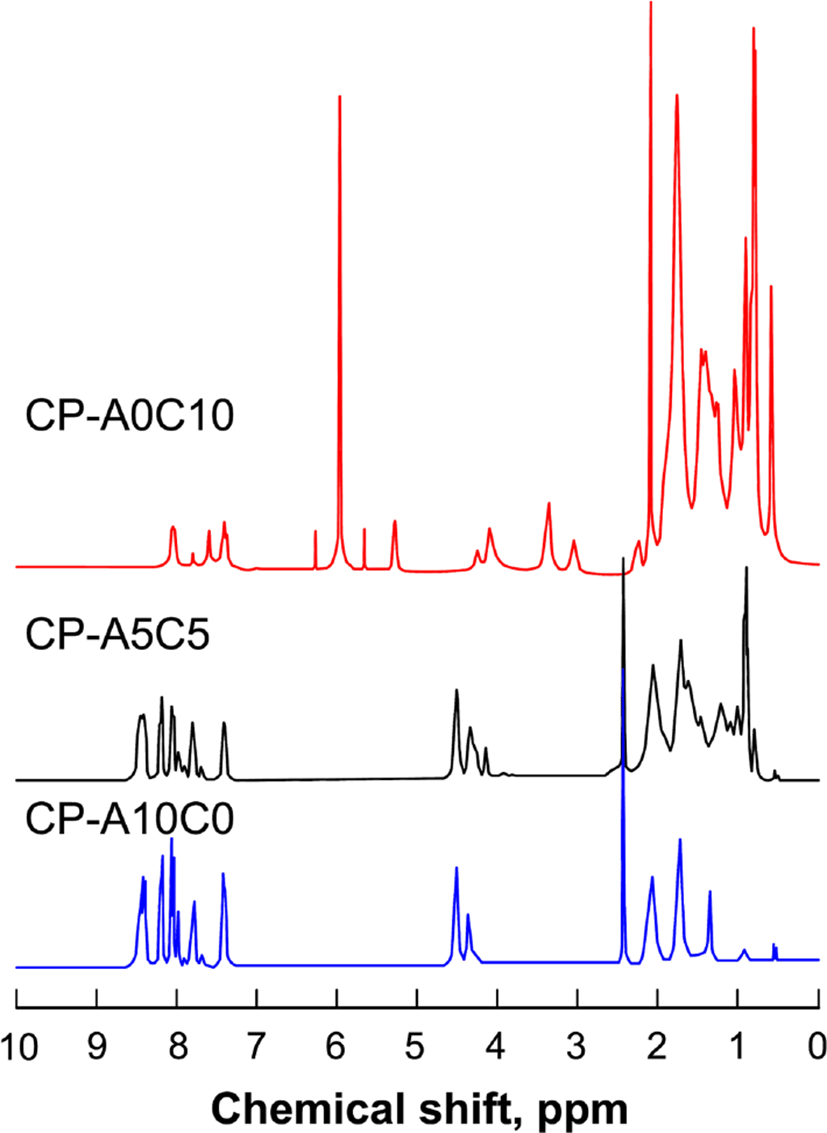
Figure 4와 5에 단독고분자인 CP-A0C10과 CP-A10C0, 혼성고분자인 CP-A5C5의 측정된 FT-IR과 1H-NMR 스펙트라를 나타내었다.
IR 스펙트라(υmax, cm−1)의 측정 결과, 모든 액정고분자들에서 1726 (C=O, ester) 피이크를 보이고, 3400 (OH)과 1690 (C=O, acid)의 피이크가 관찰되지 않음으로써 고분자가 합성되었음을 알 수 있다. 각 고분자들은 단위체의 조성을 달리하여 합성되었기 때문에 IR 스펙트럼의 상대적인 피이크의 크기를 살펴보면, DA-A의 조성이 큰 고분자일수록 1415 (N=N)와 2228 (C≡N), 3058 (C-H, Ar)의 피이크가 상대적으로 더 컷으며, DA-C의 조성이 큰 고분자일수록 2936 (C-H), 1450 (C=CH, cholesteryl)의 피이크가 더 크게 관찰됨으로써 고분자들이 조성 별로 잘 합성되었음을 알 수 있었다. 1H-NMR의 스펙트라의 측정 결과, 콜레스테릴기를 포함하는 고분자의 경우 콜레스테릴 구조로 인하여 0.6~2.1 (CH, CH2, CH3, cholesteryl)에서 피이크들이 중첩되어 나타났으며, 콜레스테릴 화합물의 특성피이크로써 3.1 (-O-CH<, cholesteryl), 5.3 (C=CH, cholesteryl)의 피이크가 관찰되었다. CP-A10C0의 경우 아조벤젠 화합물의 특성피이크인 7.4~8.4 (ArH)의 피이크를, CP-A5C5의 경우 아조벤젠 화합물의 특성피이크와 콜레스테릴 화합물의 특성피이크를 확인할 수 있었다.
Table 3은 각 액정고분자들의 대수점도와 용해도를 조사한 결과이다. 액정고분자들의 대수점도를 측정한 결과 0.31~0.37 dL/g의 값으로써 낮은 분자량의 고분자들이 합성되었음을 알 수 있었다. 고분자들의 유기용매에 대한 용해도는 곁사슬에 콜레스테릴기를 많이 함유하고 있는 고분자들이 상대적으로 극성이 낮은 용매에 용해도가 컷으며, 아조벤젠기를 갖는 고분자들은 극성이 큰 용매에 더 잘 용해되는 것으로 측정되었다. 이러한 결과는 측정된 고분자들이 모두 동일한 주사슬을 가지고 있으며, 분자량 또한 유사할 것으로 예상되기 때문에 고분자들의 용해도는 곁사슬의 구조와 함량에 기인하는 것으로 볼 수 있다. 따라서, 두 종류의 곁사슬의 구조의 차이로부터 용해도의 결과를 비교해 볼 때, 곁사슬에 콜레스테릴기를 갖는 경우가 아조벤젠기를 갖는 경우 보다 더 벌키하고, 더 낮은 극성을 갖기 때문인 것으로 판단된다.
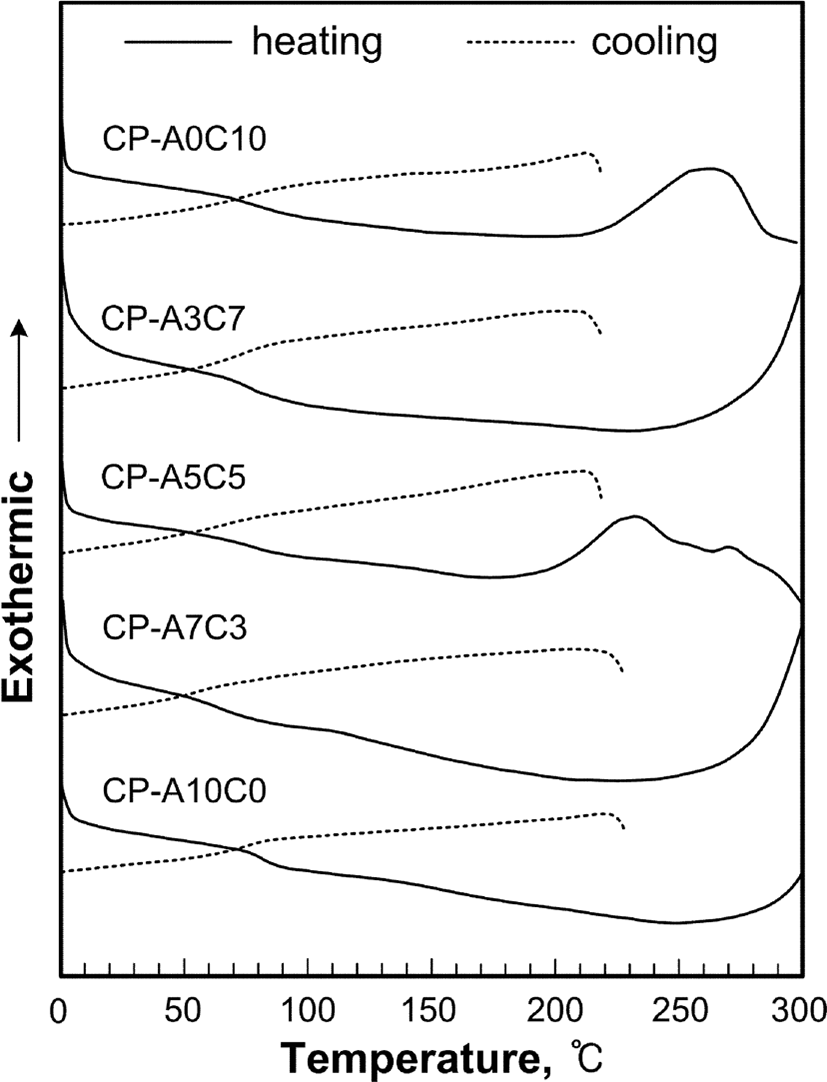
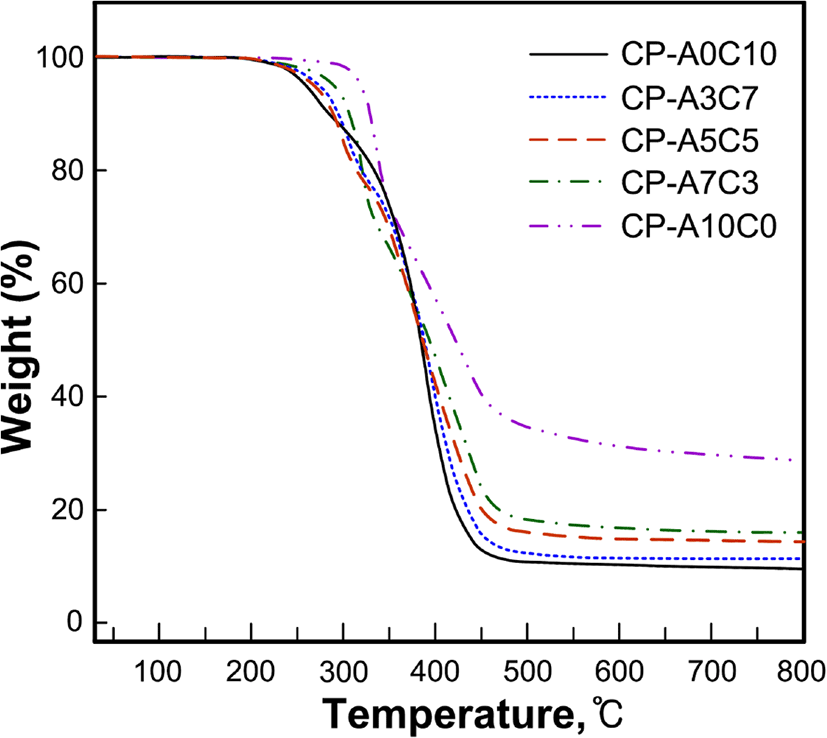
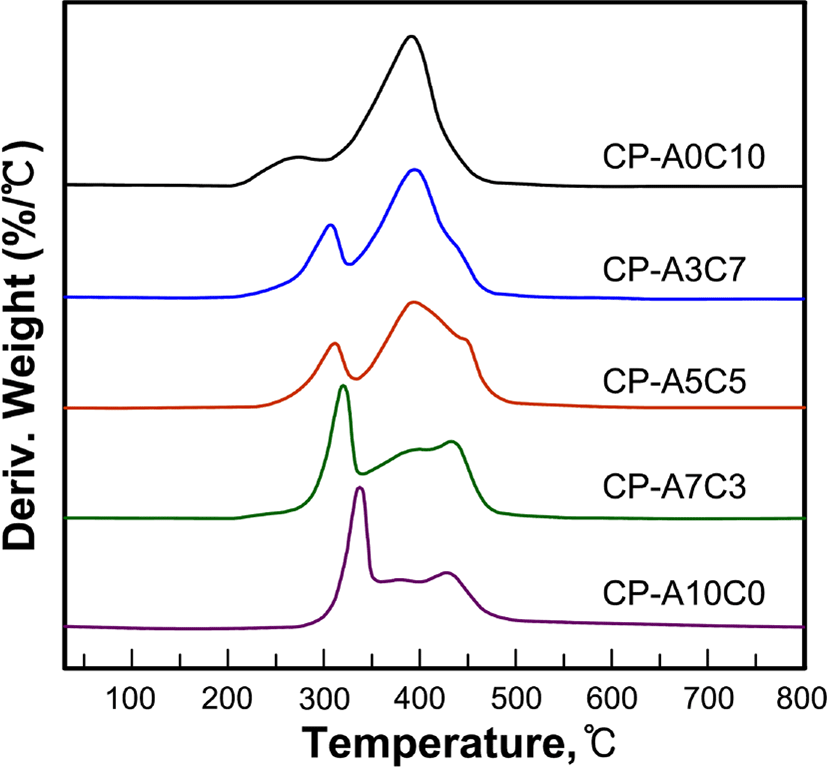
Figure 6, 7, 8 그리고 Table 4는 합성된 액정고분자들의 DSC와 TGA 열곡선 그리고 이로부터 얻어진 열역학적인 값들을 정리한 것으로 유리전이온도(Tg)는 2차 가열곡선으로부터 얻어진 것이다.
모든 액정고분자들은 용융전이온도(Tm)와 결정화온도(Tc)가 나타나지 않았으며 유리전이온도(Tg)만을 나타내는 비결정성 고분자였다. 고분자들의 Tg는 단독고분자인 CP-A10C0와 CP-A0C10의 경우, 각각 75℃와 82℃였으며, 혼성고분자들의 경우, 콜레스테릴기를 갖는 곁사슬의 함량이 많을수록 더 높게 나타났다. 이는 콜레스테릴기를 갖는 곁사슬이 아조벤젠기를 갖는 곁사슬보다 더 벌키하여 회전운동에 더 높은 에너지를 요하기 때문이다. 그리고, POM의 관찰에 의하면, 고분자는 가열시 Tg 이후 온도가 높아짐에 따라 액정상을 나타내었으며, 분자내에 아조벤젠기의 함량이 증가함에 따라 액정상이 형성되는 온도가 증가하는 것을 확인하였다. 이는 아조벤젠기에 있는 단단한 방향족 환 구조의 증가와 이들의 배열에 의한 것으로 보인다.
각 고분자들의 열분해 거동을 살펴보면 곁사슬로 콜레스테릴기만을 갖는 고분자 CP-A0C10은 2단계의 열분해 거동을, 아조벤젠기를 갖는 그 외의 고분자들은 3단계의 열분해 반응을 보이고 있다, 고분자의 잔류무게비율을 고분자의 화학구조와 비교해 볼 때 1차분해반응은 고분자의 곁사슬의 말단의 일부에서부터 진행되어 서로 중첩되어 있는 2차와 3차 분해에서 나머지 곁사슬과 주사슬의 분해가 진행되는 것으로 생각된다. 이와 유사한 연구로써 Park 등22은 곁사슬을 갖는 고분자의 다단계 열분해반응에서 1차 분해반응은 곁사슬의 말단에서부터 분해가 진행됨을 보고한바 있다. 고분자들의 5 wt%의 무게손실이 있는 초기분해온도(Td-5wt%)는 258~318℃로써 아조벤젠기의 함유량이 증가할수록 높아지는 경향이 있으며, 800℃까지 가열 후 잔여량은 9.7~28.9%로써 방향족 환 구조를 가지고 있는 아조벤젠기의 함유량이 증가할수록 크게 나타났다.
합성된 액정고분자들의 액정성은 POM과 mp 측정기를 이용하여 액정상의 texture와 stiropalescence의 세기를 관찰하여 액정상의 종류와 액정성의 크기를 확인하였다. 모든 고분자들은 가열과 냉각 시에 액정성을 보이는 양방성 액정임을 확인하였고, 콜레스테릴기의 함량이 많은 고분자일수록 액정성이 감소하는 것을 확인할 수 있었다. 이로부터 아조벤젠기 보다 낮은 극성의 벌키한 콜레스테릴기를 갖는 곁사슬이 액정형성에 불리하게 작용하는 것을 알 수 있다.
Figure 9에 POM으로부터 관찰된 액정상의 texture를 나타내었다. Figure 9의 (a), (b) (c)는 고분자 CP-A0C10, CP-A3C7, CP-A5C5의 texture로써 grandjean, oily streaks, grandjean texture의 콜레스테릭상을, (d), (e)는 CP-A7C3, CP-A10C0의 texture로써 thread like와 schlieren texture의 네마틱상이 각각 관찰되었다. 특히, 고분자 CP-A3C7와 CP-A5C5의 경우 액정상 온도범위에서 녹색계열의 열변색 현상을 관찰할 수 있었다. 곁사슬에 콜레스테릴기만을 갖는 고분자 CP-A0C10은 열변색 현상이 관찰되지 않았는데 이는 너무 약한 액정성 때문인 것으로 생각된다.

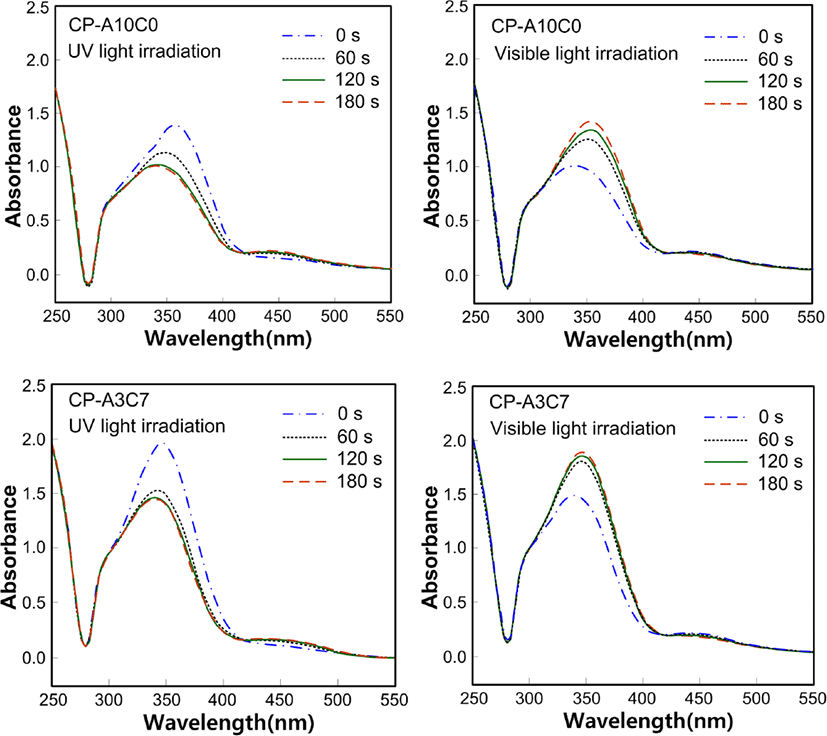
Figure 10는 아조벤젠기를 곁사슬에 갖는 고분자들의 광화학성을 조사하기 위하여 측정한 UV-Vis 흡수 스펙트라이다. 고분자들은 유사한 화학구조로 인하여 비슷한 형태의 스펙트럼을 나타내었기 때문에 CP-A10C0과 CP-A3C7의 스펙트라를 대표적으로 보여 주었다.
광화학성 측정에 사용된 고분자들은 자외선을 조사하는 시간이 증가할수록 trans-아조기의 함량이 감소하고 cis-아조기의 함량이 증가하여 365 nm 파장에서의 흡수율이 감소하고 450 nm 파장에서의 흡수율이 증가하였다. 가시광선을 조사하였을 때에는 이와는 반대의 경향이 나타남으로써 아조벤젠기의 광 이성질화 현상을 확인할 수 있었다.
각 고분자들의 광 이성질화 속도상수를 구하기 위하여 스펙트럼에서 얻어진 365 nm에서의 얻어진 광 이성질화 속도의 값을 Table 5에 나타내었다. 측정된 모든 고분자들이 유사한 화학구조를 갖기 때문에 자외선을 조사하였을 때 광 이성질화 속도상수 값은 유사한 값으로 경향성을 보이는 반면 가시광선을 조사하였을 때는 경향성을 보이지 않았다.
Conclusions
본 연구에서는 메소젠기로써 아조벤젠기와 콜레스테릴기를 사용하여 복합형 액정고분자를 합성하였다. 주사슬의 메소젠기로써 아조벤젠기를, 곁사슬 메소젠기로써 아조벤젠기와 콜레스테릴기를 갖도록 복합형 액정고분자를 설계하여 합성하고 이들의 특성을 조사한 결론은 다음과 같다.
복합형 액정고분자들은 곁사슬의 벌키성으로 인하여 모두 비결정성 고분자였으며, 모두 양방성 액정임이 확인하였다. 곁사슬에 아조벤젠기의 함량이 증가할수록 네마틱 액정상을, 콜레스테릴기의 함량이 증가할수록 콜레스테릭상을 나타냈으나 액정성은 작아지는 것으로 관찰되었다. 고분자들 중, CP-A3C7와 CP-A5C5 만이 열 변색 현상을 보여 주었다. 따라서, 고온에서의 열변색 액정고분자를 제조하기 위해서는 주사슬을 구성하는 단위체의 함량을 조절함으로써 열변색 가능온도를 조절할 수 있으며, 곁사슬의 메소젠기의 함량을 조절함으로써 액정상과 열변색성을 조절할 수 있을 것으로 판단된다. 고분자들은 자외선-가시광선 조사에 의하여 광이성질화 현상을 나타냈으며, 계산된 광이성질화 속도는 고분자들의 화학구조의 유사성으로 인하여 비슷한 값으로 확인되었다.