Introduction
약물전달체는 약물의 주입 및 전달 과정에서 발생할 수 있는 손상 및 손실을 줄이고, 적정 부위에 약물을 전달하여 치료효과를 높이는 목적을 지니고 개발되고 있다.1-3 난용성 약물의 경우는 약물전달체의 내부에 담지 됨으로써, 용해도로 인하여 야기되는 문제를 해결할 수도 있다. 이러한 시도로, 초창기에는 생체의 인지질(phospholipid)과 유사한 지질 분자들을 이용한 리포좀(liposome) 등의 연성 담지체를 사용하였다. 혹은 다양한 작용기의 도입과 약물의 결합이 용이한 고분자형 전달제재를 사용하기도 하였다. 고분자의 경우 블록공중합체 등을 사용하여, 자기조립된 마이셀(micelle), 혹은 리포좀과 유사한 베시클(vesicle) 타입의 전달체가 적용되기도 하였다. 이러한 유기 분자에 기반한 약물전달체의 개발은 개질의 용이성과 약물과의 친밀성 등의 장점을 바탕으로 많은 연구가 이루어졌다. 약물전달체 개발에 고려되는 주요 요소로는 약물전달체의 크기, 약물의 담지능력, 표면 개질을 통한 표적지향성의 실현, 적절한 수준의 약물 방출 능력, 그리고 생체친화성 등을 들 수 있다. 이와 같이 약물전달체의 개발은 여러 가지 난제가 공존하면서도 다양한 연구 접근을 통해 꾸준한 물성의 향상과 새로운 가능성을 보이고 있는 분야이다.
연성 소재를 이용한 약물전달체의 개발은 합성의 다양성과 접근성 덕분에 많은 발전을 이루었지만, 뛰어난 자극응답성으로 인해 원하지 않는 조건에서도 약물이 방출될 수 있는 가능성은 배제하기 어렵다. 즉, 스위치를 on-off 하는 것처럼, 약물을 원하는 조건에서만 방출할 수 있는 계단함수형의 약물방출 거동을 띄는 전달체의 개발은 연성 소재만을 이용해서는 한계를 극복하기가 쉽지 않은 문제이다.4-6
2003년 일본의 Masahiro Fusiwara의 연구그룹은 다공성 실리카의 일종인 MCM-41의 표면을 coumarin 분자로 개질하였다(Figure 1).7 Coumarin은 310 nm 이상의 UV 영역의 빛을 조사하게 되면, photodimerization이 일어날 수 있는데, 이럴 경우 MCM-41의 채널 입구가 막히게 된다. 따라서, 내부 채널에 약물을 담지하고, coumarin 분자로 채널을 막게 되면 효과적으로 약물을 담지한 채로 유지할 수 있다. 실리카는 연성 소재에 비해 매우 견고하므로, 채널 입구의 coumarin gatekeerp 분자의 안정성만 유지된다면, 부적절한 약물 방출 문제를 해결할 수 있는 장점이 있다. 반면, 250 nm의 빛을 조사하면 2-3 분 내에 다시 coumarin의 단량체 형태로 복귀되므로, 채널의 입구가 열리게 된다. 따라서, 빛의 파장에 따라 약물의 안정한 담지와 방출이 가능하게 된다.
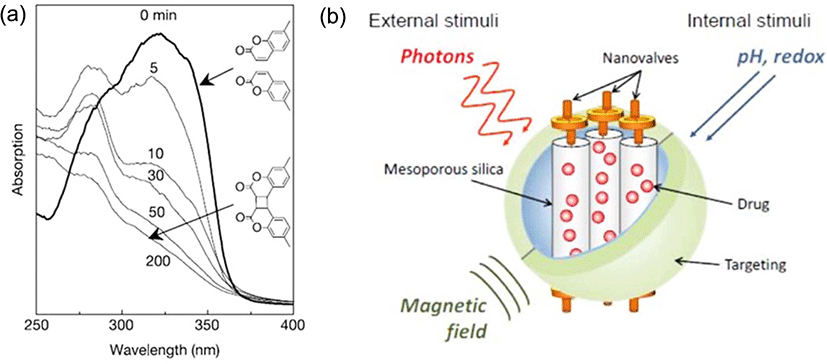
다공성 실리카 나노입자는 넓은 비표면적과 약물 분자를 담지하기에 용이한 기공의 크기, 작은 입자 크기로 인해 약물 전달을 위한 소재 물질로서 각광을 받고 있다(Figure 1b). 특히, 입자의 외곽에 기공의 물질 전달을 제어할 수 있는 표면 작용기를 적절하게 설계할 경우, 다양한 자극에 따른 약물 방출을 조절할 수 있기 때문에 지난 10 여 년간 수많은 연구가 이루어졌다. 미국의 Stoddart 교수와 Zink 교수의 공동연구진은 Fusiwara의 시스템에서 더 나아가 다양한 형태의 gatekeeper 분자를 다공성 실리카 나노입자의 외곽에 도입하는 연구를 선보였다.8,9 본 논문에서는 새롭게 부각되고 있는 유무기 하이브리드 타입의 새로운 약물전달체에 대해 개론적 부분과 실험적 접근법에 대해 소개하고, 특히 광 감응형 약물전달체의 개발과 관련된 부분을 화학적 측면에서 소개하고자 한다.
Experimental
양이온성 계면활성제인 cetyltrimethylammonium bromide (CTAB) 0.107 g을 증류수 48 mL에 분산시킨다. 그리고 NaOH (2 M, 0.35 mL) 용액을 첨가한 후, 상온에서 15분간 교반을 지속한다.10 Tetraethylorthosilicate (TEOS)를 추가한 후, 80도로 온도를 상승시켜 2시간 동안 교반한다. 뿌옇게 변한 용액을 상온으로 식힌 후, 원심분리를 통해 고체를 수득한다. 이는 methanol 용액으로 수 차례 세척한 후, 진공 건조하여 사용하였다. 만들어진 MCM-41은 X-ray diffraction (XRD)를 이용하여 분석하였으며, d110의 격자 간격이 40.5Å 이며, 실리카 벽의 두께는 6.3Å 으로 확인되었다. Barrett-Joyner-Halenda (BJH) 분석에 의한 평균 기공의 직경은 약 2.35 nm이며, 이러한 간격, 두께, 직경 등은 합성 조건에 따라 다소 달라질 수 있다. 기공을 채우고 있는 CTAB 분자를 제거할 경우는 산성의 알코올 용액에 담지하여 약 60도에서 24시간 정도 세척하여 사용한다. 혹은 MCM-41 나노입자의 표면 개질을 우선적으로 할 경우에는 표면 개질 후, CTAB을 제거하여야, 선택적으로 최외곽 표면만 개질이 가능하다.
MCM-41을 amine으로 개질 할 경우, 대표적인 방법은 3-aminopropyltriethoxysilane (APTES)를 사용하는 방법이다 (Figure 2). 표면만 선택적으로 개질할 경우, CTAB을 제거하지 않은 MCM-41 분말을 APTES가 함유된 toluene 용액에 노출시켜 기상으로 개질하는 방법이 있다. 이 방법을 이용할 경우, 3-(triethoxysilyl)propyl isocyanate 도 동일한 방식으로 표면에 도출이 가능하다. 다만 isocyanate는 수분에 반응하여 활성을 잃을 수 있으므로, 바로 사용하거나 보관에 유의하여야 한다. 개질 반응 후에는 원심분리를 한 후, toluene 등으로 세척한다. Amine이 개질된 입자의 경우는 FT-IR 혹은 ninhydrin test 등을 이용하여 표면의 개질 여부를 확인할 수 있다. FT-IR에서는 1636 cm−1 의 피크를 통해 개질 여부를 판단하며, 2927과 2856 cm−1 에서 C-H stretching vibration의 피크를 추가로 확인하여 개질의 성공 여부를 확인 가능하다. 일차 amine의 개질은 ninhydrin 용액에 입자를 담그고 열을 가하여 생기는 보라색 계열의 발색을 통해 성공 여부를 육안으로 확인 가능하다. NCO의 개질은 2270 cm−1 부근의 symmetric stretching vibration peak 를 통해 확인한다.11
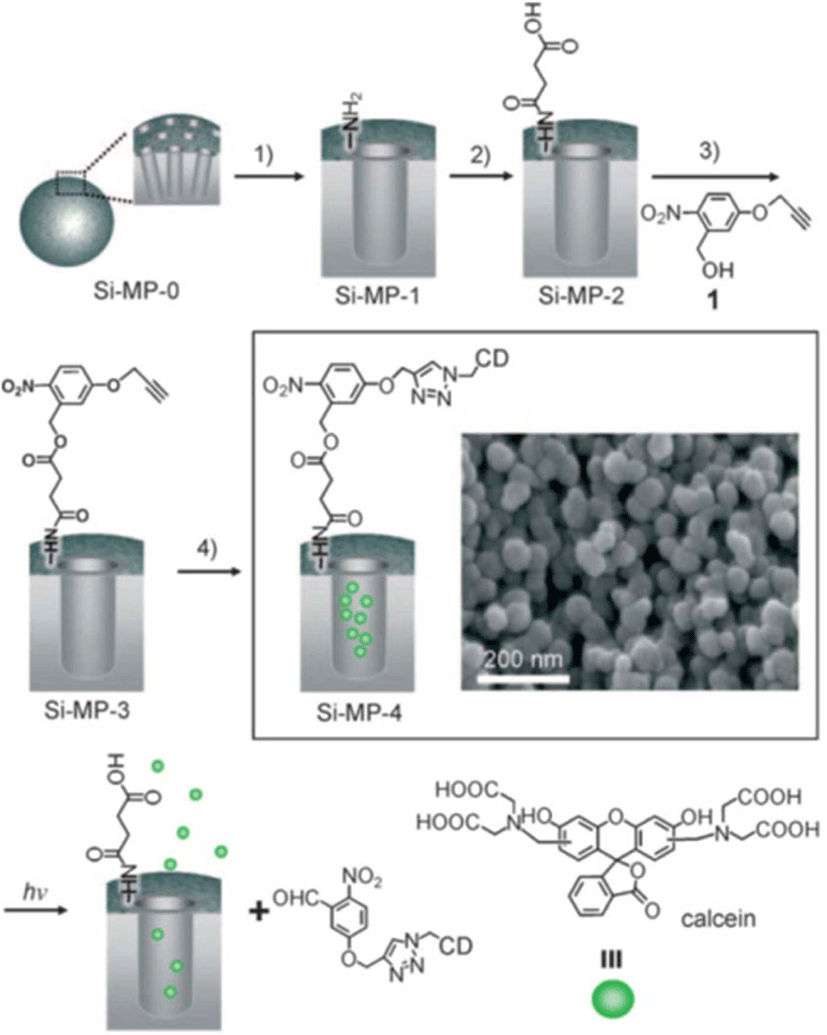
카르복실기를 추가적으로 도입하고자 하는 경우, amine이 개질된 MCM-41 (90 mg)을 dimethyl sulfoxide (DMSO) 용액에 분산 후, succinic anhydride (0.04 g)과 trimethylamine (0.04 g)을 넣고 40도에서 이틀간 교반하였다(Figure 2).11 개질이 완료되면 원심분리(9000 rpm)를 통해 입자 분말을 얻은 후 ethanol으로 세척하였다. 이 단계에서 CTAB을 제거하고자 하는 경우, HCl/Methanol (0.9 mL/16 mL) 용액에 입자를 넣고 60도에서 24시간 교반하였다. 원심분리를 통해 입자를 얻은 후 methanol을 이용하여 수 차례 세척하고 사용하였다.
Nitrobenzyl ester 계열의 작용기는 UV 계열의 광 조사 시 광분해 반응이 일어나면서 카르복실산을 생성한다. MCM-41의 표면에 nitrobenzyl 계열의 기능성 작용기를 도입할 경우, 5-hydroxy-2-nitrobenzyl alcohol 과 같은 분자를 이용하게 되면 추가적인 작용기 도입이 용이할 수 있다(Figure 2).11
예를 들어, Figure 2의 분자 1은 alcohol 작용기와 carboxylic acid 혹은 NCO 작용기와 결합이 용이하다. Propargyl 작용기는 추가적으로 다른 작용기를 도입하기 용이하다. 우선, 이상의 분자는 5-hydroxy-2-nitrobenzyl alcohol (1 g, 5.9 mmol) 를 녹인 toluene 용액(50 mL)에 propargyl bromide (2.64 g, 22 mmol)를 추가하고, ethanol (10 mL)에 sodium hydroxide (0.52 g, 13 mmol)를 분산한 용액을 추가하여 질소분위기 하의 70도에서 이틀간 교반하였다. 상온으로 식힌 후, 침전물은 제거하고, 용매를 증발시켰다. 얻어진 물질은 methylene chloride (100 mL)에 녹이고, n-hexane을 이용하여 적절히 침전시켜 정제하였다. 분석은 문헌에 보고된 바와 같이 NMR 등을 이용하여 확인할 수 있다.111H NMR (400 MHz, DMSO-d6) δ 3.67 (s, 1H, CH≡C-), 4.85 (s, 2H, HO-CH2-Ph), 4.97 (s, 2H, -O-CH2-C≡CH), 7.09 (d, 1H, -Ph-), 7.40 (s, 1H, -Ph-), 8.15 (d, 2H, -Ph-); 13C NMR (100 MHz, DMSO-d6) 161.46, 142.20, 127.33, 113.79, 113.115, 79.06, 78.33, 60.12, 56.17.
Propargyl nitrobenzyl alcohol (40 mg)은 카르복실산으로 치환된 MCM-41 (33 mg)의 표면에 결합이 가능하며, DMSO 용액(30 mL)에 분산 후 N,N’-diisopropylcarbodiimide (0.08 g), 과 4-(dimethylamino)pyridine (0.08 g)를 첨가한 후 40도에서 24시간 교반하여 진행하였다. 원심분리 후, DMSO 등으로 세척하여 건조하였다.11
약물의 담지를 위해 이상과 같이 기능화된 실리카 입자(20 mg)와 약물분자(20 mg) 을 PBS 버퍼 용액(7 mL, pH 7.4)와 DMF (2 mL)에 분산한다. 상온에서 이를 24시간 교반 후, mono‐6‐azido‐β‐CD (25 mg)를 넣고, 녹인 후 CuSO4·5 H2O (20 mg, 80 μmol), sodium ascorbate (31 mg, 156 μmol)를 추가하여 상온의 질소 분위기 하에서 3일간 교반하였다(Figure 2). 원심분리를 통해 얻어진 입자는 증류수와 methanol으로 세척하였다.11 Cyclodextrin이 접합된 표면은 cyclodextrin의 입체적 장애로 인한 채널의 물질수송을 저해하게 된다. 이와는 다른 접근법으로는 소수성 작용기를 click 반응을 통해 도입함으로써, 표면에너지 변환에 따른 물질수송의 저해 방식도 고려할 수 있다.
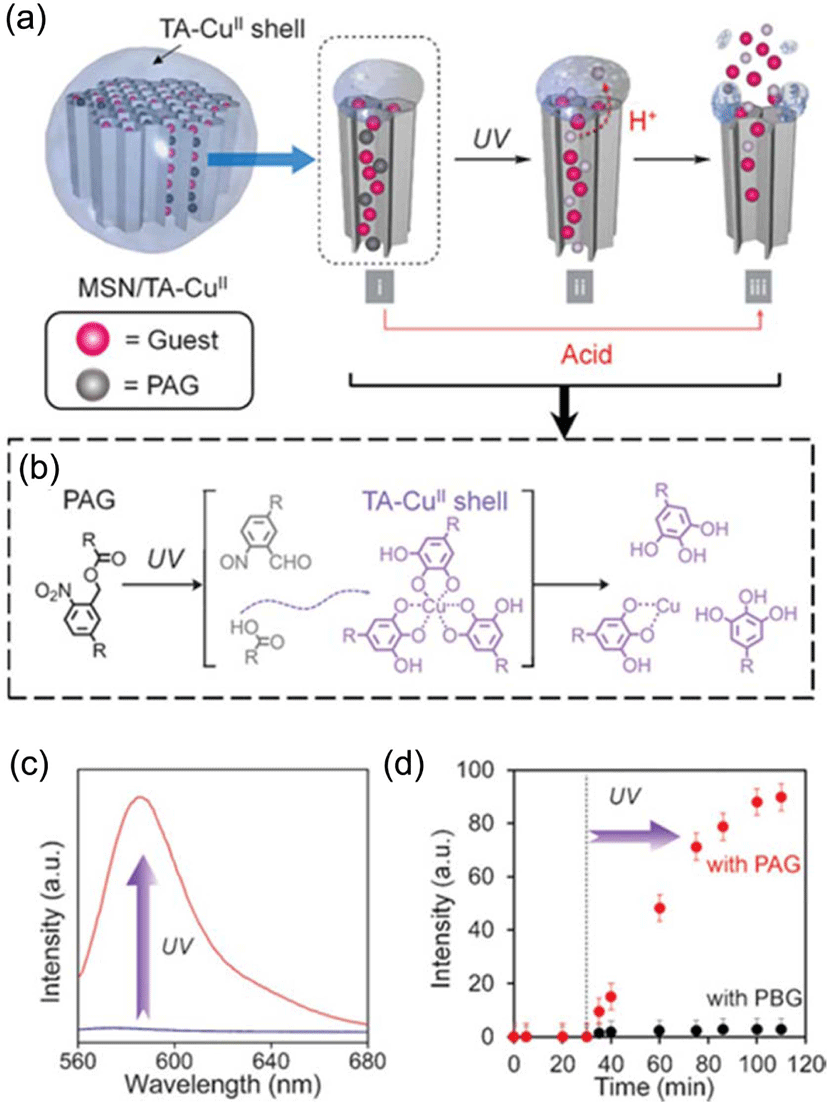
앞서 설명한 광분해성 작용기를 도입한 MCM-41의 합성은 여러 단계를 거쳐야 하는 번거로움이 있다. 최근에 본 연구실에서 보고된 방법에 의하면, 단순히 표면이 개질 되지 않은 MCM-41에 CTAB 계면활성제만 제거한 입자를 이용하여 동일한 기능성을 구현할 수 있다.12 이를 위해 CTAB을 제거한 MCM-41 입자(20 mg)을 분산시킨 DMF 용액에 약물분자(예: Rhodamine B, 10 mg)와 광산제(photoacid generator, 10 mg)을 넣고 상온에서 교반한다. 원심분리를 통해 간략히 초과된 약물 등을 제거하고, 재빠르게 증류수를 추가한 후, tannic acid (10 μl, 24 mM)와 copper chloride (10 μl, 24 mM)를 빠른 시간 내에 추가하면서 격렬히 교반하였다(Figure 3). 코팅은 수 초내에 이루어지며, 10분 후 원심분리를 통해 초과된 물질 들을 세척하여 정제한다.
Results and Discussion
다양한 자극감응형 약물전달체 중 광감응형 약물전달체는 원하는 지점과 시점에 외부에서 리모트 컨트롤을 할 수 있는 장점이 가장 두드러진다. 빛에 의한 약물 방출 시스템은 연성 나노전달체 등에 이미 여러 차례 적용된 바 있다. 작용 메커니즘 측면에서 광감응형 약물 전달체는 크게 1) 광감응형 작용기의 transformation에 의한 입체장애 변이 혹은 물리적 동력 발생, 2) 광분해 반응에 의한 입체장애 제어 혹은 기타 물리화학적 조건 변화, 또는 3) 광흡수에 따른 온도 변화 혹은 pH 변화 등에 의한 확산거동 변이에 따른 약물 방출 시스템으로 구분할 수 있다. 하지만, 앞서 언급한 바와 같이 대부분의 연성 약물전달체는 안정성 확보가 관건이다. 다공성 실리카에 도입된 분자기계 형의 광감응형 분자 gatekeeper 들 또한 이상과 같이 광감응형 연성 약물 전달체에 적용되는 3가지 범주의 약물 방출 거동을 따를 수 있다. 첫 번째 메커니즘인 광감응형 작용기의 transformation에 의한 시스템은 이미 서론에서 언급한 Fusiwara 그룹의 coumarin gatekeeper (광반응에 의한 가역적인 dimerization) 시스템에서도 확인할 수 있으며, UCLA의 Zink 그룹 등에서 보고한 azobenzene (광반응에 의한 cis-trans isomerization 적용)이 도입된 시스템 등도 포함될 수 있다. Figure 5에서 확인할 수 있는 바와 같이 azobenzene에 의해 MCM-41의 채널 내부에 입체적으로 포집된 약물 분자들은 UV 조사에 의해 azobenzene의 cis isomerization이 유발되어 약물의 방출을 유도한다(Figure 5).13
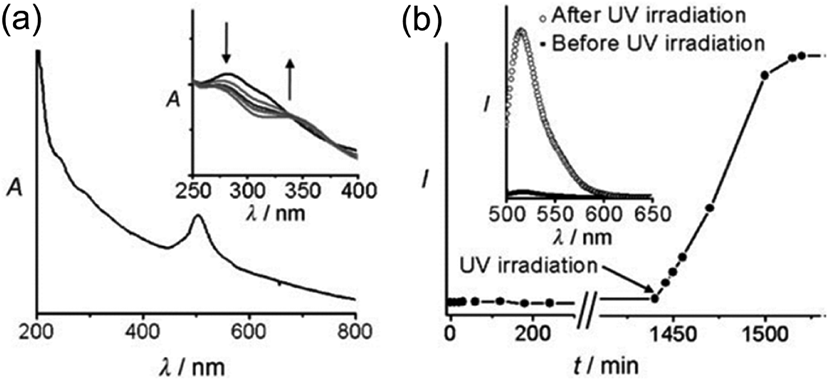
이와 달리 두 번째 메커니즘을 따르는 광분해형 gatekeeper 를 이용한 시스템은 Figure 2의 유형이 대표적 형태로 들 수 있다. 본 연구실에서는 UV 파장의 빛에 의해 광분해가 발생할 수 있는 nitrobenzyl ester 작용기를 MCM-41 나노입자의 표면에 도입하고, click 반응을 통해 입체적 크기가 MCM-41의 기공을 막기에 충분한 cyclodextrin을 추가적으로 도입하였다(Figure 2).11Figure 2의 Si-MP-4 입자는 Figure 4에서 확인할 수 있는 바와 같이, UV 조사에 의해 점진적으로 photolysis 가 발생함을 볼 수 있으며, 약물의 방출 또한 급격히 빨라지는 것을 확인할 수 있다. 이 시스템의 경우 Figure 2의 분자 1의 개질에 따라 다양한 작용기 부여와 기능성 구현도 가능할 것으로 기대된다.
광분해형 약물담지체의 경우 이상과 같은 유형을 바탕으로 다양한 시도가 이루어졌지만, 많은 합성 단계를 거쳐야 한다는 단점이 남아 있다. 최근 본 연구실에서는 Figure 3에서 보는 바와 같이 UV에 감응하는 photoacid generator 분자와 약물을 MCM-41의 채널 내부에 동시에 담지 시키고, 표면을 tannic acid로 코팅 후, Cu(II)로 배위시켜 빠른 시간 내에 안정화 시켰다. Figure 3에 도입된 tannic acid와 Cu(II)의 배위결합체는 산성의 pH에서 해리가 되는 특성이 있다.12 따라서, UV에 감응하여 광분해 반응을 일으키는 photoacid generator 분자는 산을 발생시켜 MCM-41의 표면에 코팅된 배위결합체를 해리시킬 수 있다. 이러한 작동 원리를 바탕으로 빛을 조사하기 전에는 매우 안정하게 약물을 담지하고 있다가, 선택적인 파장의 빛을 통해 약물이 방출되는 효과적인 거동을 손쉽게 구현할 수 있었다(Figure 3).
세 번째 메커니즘으로는 광흡수에 따른 온도 변화 혹은 pH 변화 등에 의한 확산거동 변이 제어 방식이 있는데, 앞서 소개한 본 연구실의 결과는 이 방식과도 일부 중첩이 될 수 있는 개념 중의 하나라고 판단할 수 있다.
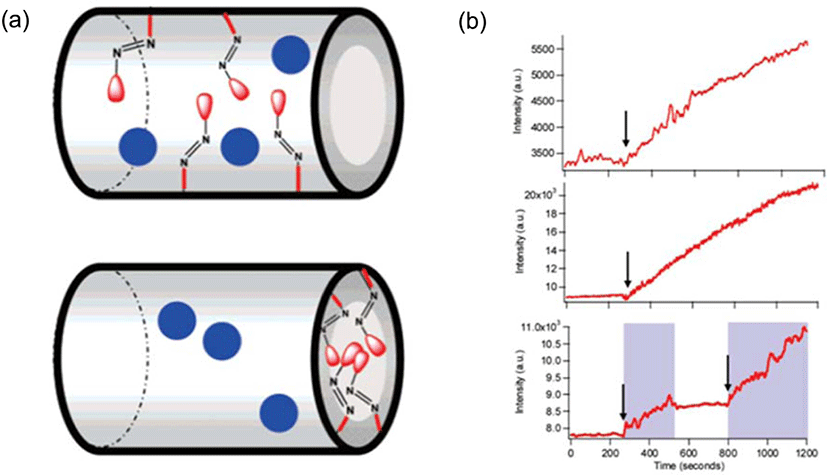
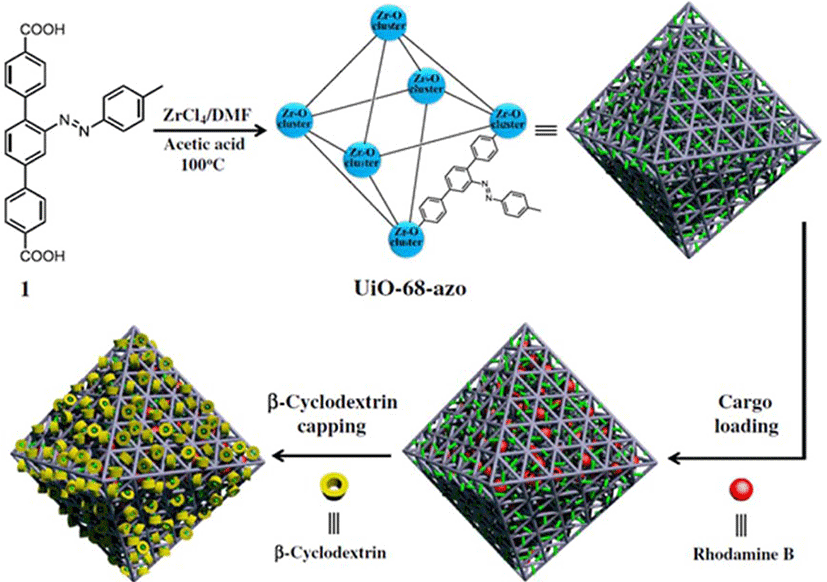
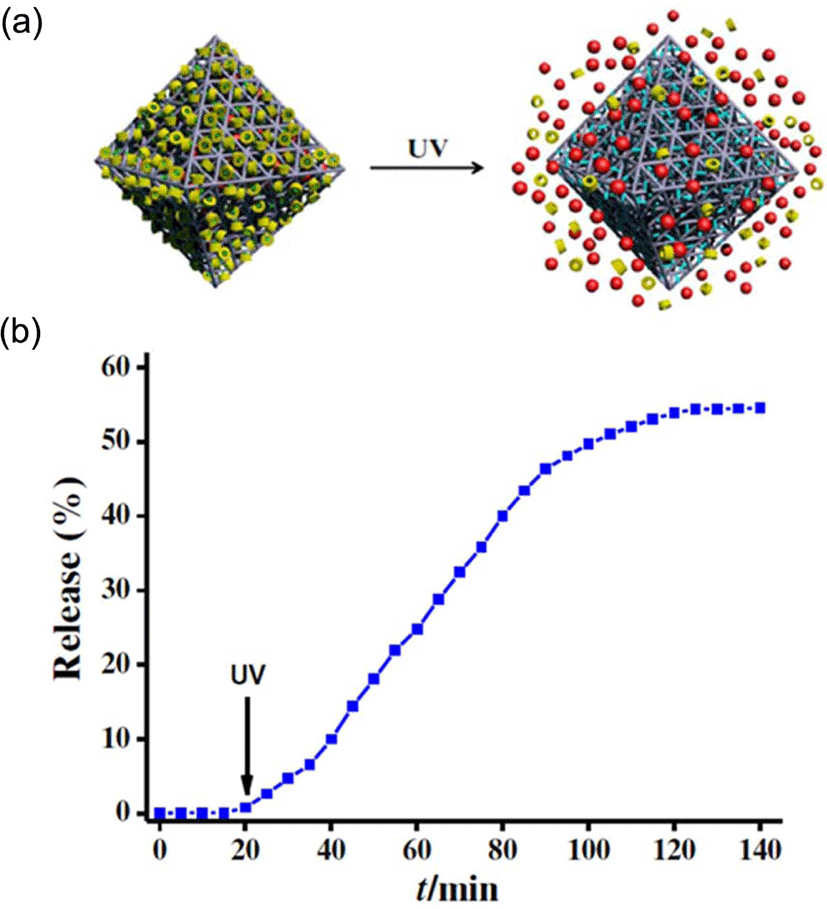
최근에는 자극감응형 gatekeeper 의 개념을 다공성 실리카 표면에 도입하는 개념에서 확장하여, 다공성 지지체인 metal-organic framework (MOF) 시스템과 융합하는 접근법이 소개되고 있다. Figure 6에서 볼 수 있는 바와 같이 광감응형 azobenzene 분자를 리간드의 적절한 위치에 도입한 후, 약물을 담지하고, azobenzene을 포집할 수 있는 거대 환형 분자인 cyclodextrin을 이용하여 기공을 막아 약물 방출을 억제하였다.14 Cyclodextrin과 azobenzene은 cis 조건에서는 안정하게 결합하지 못 하고 해리되므로, 이러한 점을 이용하여 약물 방출을 유도하는 시스템을 효과적으로 구현할 수 있다(Figure 7). 네덜란드의 Feringa 교수의 연구진은 MOF 내에 단일 방향으로 회전할 수 있는 분자를 배위결합의 네트워크에 성공적으로 도입하였다.15 이 시스템은 현재로서는 특별한 응용 사례를 보여주지는 못하지만, 단일 방향으로 물질 수송 등을 자극에 따라 제어할 수 있는 정교한 시스템 구축을 위해 기반 기술을 제공한다(Figure 8).
Conclusions
연성 약물전달체에 비해 약물의 담지 안정성이 탁월한 다공성 실리카의 일종인 MCM-41은 육각형의 기공 배열을 지니고 있어, 기공의 말단을 막아주면 다른 구조의 다공성 실리카에 비해 효과적으로 약물을 담지할 수 있다. 현재까지 다양한 형태의 자극 감응형 gatekeeper 분자가 개발되었으며, 광감응형 gatekeeper 도 구동 메커니즘에 따라 대개 3가지 정도의 유형이 보고되고 있다. 하지만, 광감응형 분자의 변이에 따른 계면에서의 표면에너지 변화 등에 대한 엄밀한 고찰이 필요하며, 최근 본 연구실에서는 광분해형 작용기를 MCM-41의 표면에 단분자층으로 도입하고, 소수성에서 친수성으로 변환하는 과정에 대해 분석한 바 있다. 특히 density functional theory (DFT)에 따른 계산에 따라 물 분자의 이동 거동과 약물 방출의 거동을 동시에 비교 분석을 한 바 있다. 앞으로 하이브리드형의 광감응형 약물 담지체는 기능적으로 진보하기 위한 노력과 동시에 물질 수송과 관련된 엄밀한 메커니즘 관련 연구도 동반되어야 할 것으로 판단된다.