Component of Rubber Composite
고무복합소재는 고무, 충전제, 가교제, 노화방지제, 공정조 제 등으로 구성되어 있다.1 충전제는 고무 배합물의 전반적 특 성을 향상시키며, 충전제의 종류에는 카본블랙, 실리카, 탄산 칼슘, 전분, 탈크, 클레이 등이 있다.2,3 가교제는 고무 사슬 간 화학적 가교를 형성하여 삼차원 네트워크를 만들어, 탄성, 강 도 및 모듈러스를 향상시키고 히스테리시스를 감소시킨다.4 가교제에는 황, 과산화물, 레졸 등이 있다. 가교 반응을 촉진 시키기 위해 촉진제를 함께 사용한다. 가황촉진제로는 설펜 아민드계와 티아졸계가 주로 사용된다.5 노화방지제는 산소 와 오존에 의한 공격을 방지하고 라디칼 연쇄반응을 차단시 켜 고무 제품을 보호하는 역할을 한다. 노화방지제로는 파라 페닐렌 디아민 유도체와 페놀계 화합물이 주로 사용된다.5 공 정조제는 고무배합물의 물리적 성질에는 악영향을 끼치지 않 으면서 가공성을 향상시키는 역할을 한다.6 그 종류에는 오일, 왁스, 스테아린산, 금속염 등이 있다.
Table 1 에 타이어, 방진고무, 와이퍼 블레이드, 신발, 오링, 절연체 등 주요 고무복합소재에 사용하는 유기 첨가제를 정 리하였다. 황 가교 시스템이 주로 사용되며, 신발과 절연체 소 재에서는 과산화물 가교 시스템이 주로 적용된다.7-22 노화방 지제는 2,2,4-trimethyl-1,2-dihydroquinoline polymer (TMQ) 와 N-isopropyl-Nߣ-phenyl-1,4-phenylenediamine (IPPD), N-(1,3-dimethylbutyl)-N’-phenyl-p-phenylenediamine (HPPD) 등이 주로 사용된다. 오링에는 가소제로 비스 (2-에틸헥실)프 탈레이트, 2-에틸헥실벤조에이트를 사용한다.22 고무 소재의 구성 성분 중 유기물 첨가제는 기체 크로마토그래피(gas chromatography, GC) 를 이용하여 분리하여 분석할 수 있다.
| Rubber Composite | Curing Agent | Antidegradant | Processing Aid | Reference |
|---|---|---|---|---|
| tire | sulfur, CBS, DCBS, CTP, OBTS | TMQ, 6PPD, 77PD, waxes | stearic acid, naphthenic process oil, esters, amines, waxes | 7-11 |
| rubber isolator | sulfur, resole, CBS | RICHNOX 1010, 6PPD | process oil, waxes | 12, 13 |
|
wind shield wiper blade |
sulfur, MBTS | TMQ, OPPD, IPPD, 4,4’-dioctyldiphenylamine, waxes | petrolatum, proprietary zinc and fatty acid blend, stearic acid, naphthenic base oil | 14, 15 |
| shoes | sulfur, MBTS | TMQ, wax | stearic acid, paraffin wax | 16-19 |
| DCP | IPPD, phenyl-α-naphthylamine | naphthenic oil, PEG, hexaoxatricosane, dioctyl phthalate | ||
| insulator | DCP, sulfur, Bis-(tertiary butylperoxyl)-diisopropyl benzene | poly-dehydroquinolines, BLE, zinc salt of mercaptotolyimidazole | petrolatum, paraffin wax, low molecular weight polyethylene | 20,21 |
| o-ring | bis(2-ethylhexyl) phthalate, 2-ethtlhexyl benzoate | 22 |
CBS: N-Cyclohexyl-2-benzothiazolesulfenamide, DCBS: N,N’-dicyclohexyl-2-benzothiazolesulfenaimde, CTP: N-(cyclohexylthio)phthalimide, OBTS: N-oxydiethylene-2-benzothiazole sulfonamide, MBTS: 2-mercaptobenzothiazole disulfide, TMQ: 2,2,4-trimethyl-1,2-dihydroquinoline polymer, RICHNOX 1010: Pentaerythritol tetrakis(3,5-di-tert-butyl-4-hydroxyhydrocinnamate), MBTS: benzothiazole disulfide, DCP: dicumylperoxide, BLE: polymeric condensation product of diphenylamine and acetone
Principle and Application of Gas Chroma-tography
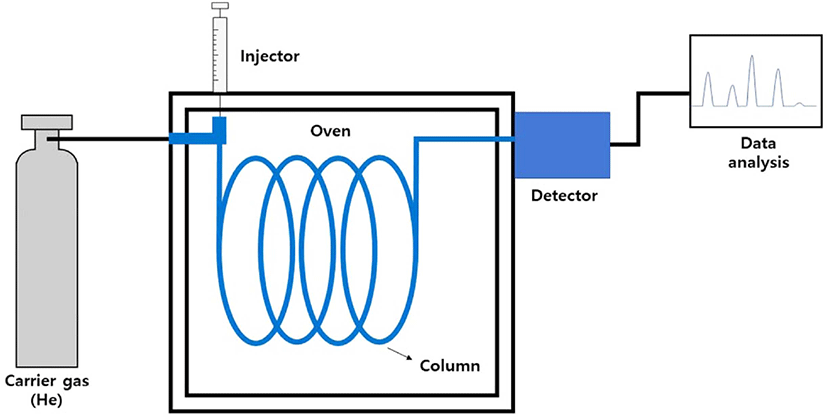
GC는 시료 주입구에서 기화된 시료 성분들이 컬럼의 정지 상과 비활성 기체 이동상 (운반 기체 ) 사이에서 분배되는 과정 을 통해 분리된다. Figure 1 은 GC 의 구성을 보여준다. GC 는 주입구, 컬럼, 검출기 등으로 구성된다. 컬럼은 충전 컬럼 (packed column) 과 모세관 컬럼 (capillary column) 으로 나눌 수 있으며, 현재 분석에서는 주로 모세관 컬럼을 사용하고 있 다. 모세관 컬럼의 정지상은 얇은 필름 혹은 다공성 층으로 코 팅되어 있으며, 충전 컬럼보다 훨씬 높은 분리 효율을 가지고 있다.23 GC 는 컬럼 오븐의 온도를 조절함으로써 머무름 시간 과 봉우리의 모양을 변화시킬 수 있다. 검출기로는 불꽃 이온 화 검출기 (flame ionization detector, FID), 전자 포획 검출기 (electron capture detector, ECD), 질량분석기(mass spectrometer, MS) 등이 주로 사용되고 있다. FID 는 주로 탄화수소 화합물 을 검출하는데 유용하고, ECD 는 할로젠 화합물을 검출하는 데 적합하다. MS 는 분리된 시료 성분을 이온화시켜 얻은 질 량 스펙트럼을 해석하여 각 성분의 화학 구조를 규명할 수 있 다.23 GC/MS 의 경우, 적은 양의 시료 주입으로 빠르게 다성 분을 정성, 정량분석을 할 수 있다는 장점이 있다. 이러한 장 점으로 미지 시료 분석에 GC/MS 를 이용하여 그 성분을 규명 할 수 있고, 그 양을 결정할 수 있다.
일반적으로 GC는 고분자량 혹은 저휘발성 유기 화합물 분 석에는 적합하지 않으며, GC 로 분석가능한 물질은 휘발성이 있고 열적 안정성을 갖는 유기물이다. Table 2 에 GC 의 주요 응용 분야를 정리하였으며, GC 는 다양한 분야에서 응용되고 있음을 보여주고 있다. 식품 분야에서는 GC 를 이용하여 살충 제 성분, 프탈레이트 에스터, 아크릴아마이드, 지방산 등을 분 석하는데 이용할 수 있다.24-48 환경 분야에서는 유기인계 살 충제 성분을 비롯하여 휘발성 유기 화합물 (VOCs) 혹은 다환 방향족 탄화수소 (PAHs) 등을 분석하는 데 사용한다.25,49-69 Wise 와 Sullivan 은 고무에서 아민 계열의 노화방지제 혼합물 을 분석하는데 GC 를 이용하였다.71 Lattimer 등은 N,N’-di-(1-methylheptyl)-p-phenylenediamine (DOPPD) 가 포함된 천연고 무(NR) 배합물을 노화시켜 산화 메커니즘을 규명하는데 GC/MS를 이용하였다.72 산화된 DOPPD는 LC/MS로 분석이 어려 웠으나, GC/MS 로 DOPPD의 오존 생성물을 분리하여 검출하 였다. Delaunay-Bertoncini 등은 포장재로 사용되는 부틸고무 에서 저분자량 화합물을 추출하여 GC/MS로 분석하여, 알칸, 알켄, 페놀계 화합물, 방향족 화합물, 프탈레이트, 카복실산, 고리 황화합물 등 100 가지 이상의 화합물을 발견할수있 었다.73
| Field | Analysis Chemical | Reference |
|---|---|---|
| food | organochlorine pesticides | 24-26 |
| organophosphorus pesticides | 24-27 | |
| fungicides | 26, 28, 29 | |
| phthalate ester | 30-38 | |
| acrylamide | 39-42 | |
| Fatty acid | 43-48 | |
| environment | organophosphorus pesticides | 25, 49-55 |
| organochlorine pesticides | 56-60 | |
| Triazine herbicides | 53, 59, 61-64 | |
| dinitroaniline herbicides | 61, 65 | |
| volatile organic compounds (VOCs) | 66 | |
| polycyclic aromatic hydrocarbons (PAHs) | 67-69 | |
| rubber | alkylphenol | 70 |
| amine type antidegradants | 71 |
Extraction methods of Organic materials from Rubber Composite
고무 배합물이나 가교물에 첨가된 유기물을 GC 로 분석하 기 위해서는 먼저 이들을 추출해야 한다. 고무 소재에서 유기 물을 추출할 때 사용할 수 있는 추출 방법은 다음과 같다.
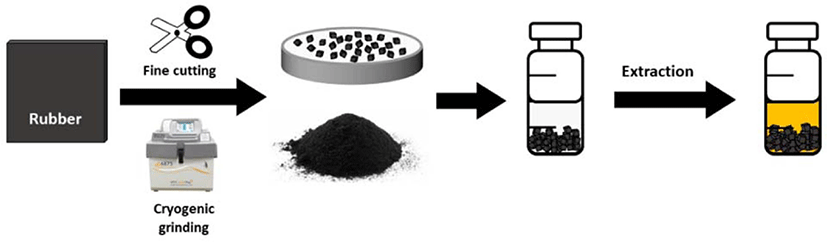
Figure 2 에용매를 이용한 추출 과정을 나타냈다. 용매 추 출은 먼저 고무를 작은 조각으로 자르거나 분쇄한다. 고무 조 각이 크면 추출 효율이 떨어지기 때문에 1 mm 이하의 크기 로 잘라야 한다. 극저온 분쇄기를 이용하면 더 미세한 입자로 만들 수 있다. 극저온 분쇄기는 액체질소로 고무를 냉각시킨 후 해머 밀 등으로 고무를 분쇄한다. 공정에 따라 분쇄된 고 무의 크기, 형상 등이 달라질 수 있다.74 분쇄한 고운 고무 가 루를 사용하는 경우, 고무 가루가 팽윤되고 서로 뭉쳐 추출된 유기물이 갇히게 될 수 있으므로 오히려 추출 효율이 떨어질 수 있다. 고무 조각을 바이알에 넣고, 추출 용매를 가한 후밀 봉하여 오븐에 넣어 추출을 진행한다. 용매 추출법은 비교적 간단하고 효율이 우수한 방법이지만, 용매에 따라 추출효율 이 다르다는 것을명심해야 한다.75 추출 용매는 추출할 유기 물에 대한 용해도가 우수해야 하며 가교 고무를 어느 정도 팽 윤 시킬 수 있는 것을 선택하는 것이 바람직하다. 용매 종류 와 추출 유기물 성분 그리고 매트릭스 특성에 따라 추출 효 율이 달라질 수 있다. Spell 과 Eddy 는 폴리프로필렌(PP)에서 첨가제의 추출을 연구했다.76 그들은 고분자의 밀도에 따라필 요한 추출 시간이 선형적으로 변하고 입자 크기가 증가함에 따라 감소한다는 것을발견했다.
Table 3 에 다양한 고무 소재에서 용매 추출법을 적용한 예 를 정리하여 나타내었다.75,77-81 추출 용매로는 아세톤, 아세토 나이트릴, 헥산 등이 주로 사용되며 클로로폼과 tetrahydrofuran (THF) 등도 사용하고 있다. 고무 소재에서 용매 추출법 을 이용하여 추출할 수 있는 성분은 촉진제, 노화방지제, 가 소제등이 있다. Lattimer 와 Harris 는 SBR 배합물에서 유기물 (왁스, 배합유, 산화방지제, 촉진제 등 )을 아세톤과 아세토나 이트릴로 추출하여 GC-FID 로 분석하였다.75 Wils 등은 자동 차 창문의 씰링용 고무 소재에서 메틸렌클로라이드를 용매로 사용하여 유기물을 추출하여 분석하였다.79
| Rubber | Solvent | Extracted Substance | Reference |
|---|---|---|---|
| NR | acetone | accelerator | 77 |
| sulfuric acid | hydroxylamine | 78 | |
| SBR | acetone | HPPD, TMQ, paraffine | 75 |
| acetonitrile | wax, OBTS | 75, 81 | |
| n-hexane | wax, process Oil | 81 | |
| NBR | n-hexane | ZDBC, ZDE, DEHP, BHT | 80 |
| EPM | methylene chloride | hydrocarbons | 79 |
Figure 3 은 속실렛 추출 기구를 보여준다. 속실렛 추출을 하 기 위해서는 먼저 팀블에 고무 시험편을 잘라 넣는다. 둥근 플 라스크에 추출 용매를 담아 맨틀에 둔다. 용매를 가열하기 시 작하면 Figure 3 에서 볼 수있듯이 기화된 용매가 증류관을 통 해 팀블 쪽으로 이동한다. 컨덴서에 흐르는 물에 의해 냉각되 고다시 응축되어 액체가 된다. 다시 액체가 된용매에는 용 출된 유기물이 포함되어 사이폰을 통해 둥근 플라스크에 모 이게 된다. 속실렛 추출은 장치가 비교적 간단하며 추출 후 여 과가 필요 없다는 장점이 있다. 하지만 추출 시간이 오래 걸 리며, 용매를 대량으로 사용한다는 단점이 있다. 뜨거운용매 에 장시간 시료가 노출되면 일부 분석물질이 손상될 가능성 도 있다.82
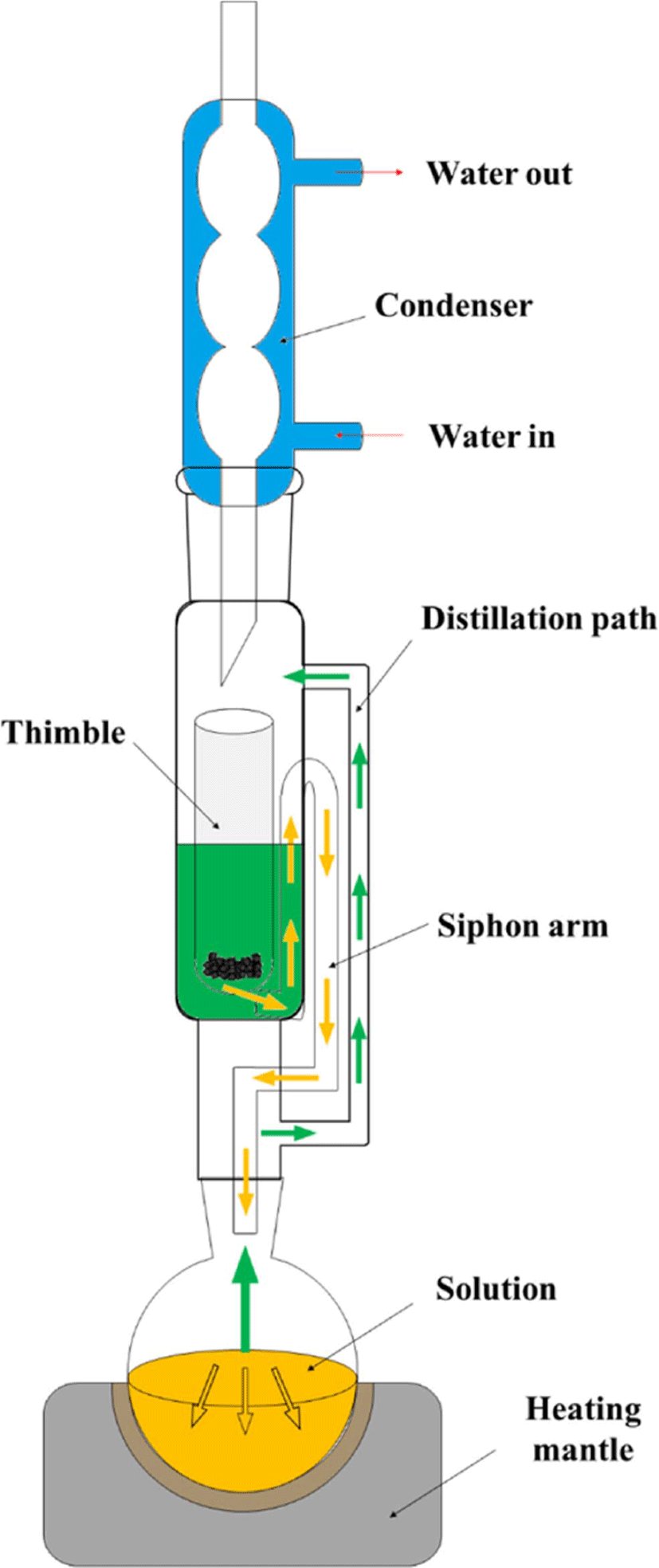
Table 4 는 속실렛을 이용하여 고무 소재에서 추출된 추출물 을 분석한 예를 정리하였다.73,75,85-87 속실렛 추출법을 사용하 는 경우, 휘발성이 높은 추출물은 일부 용매와 함께 휘발되어 사라질 수도 있다. 속실렛 추출은 다양한 고무에서 적용 가능 하지만 다른 추출법에 비해 유기성분 분석을 위한 추출 방법 으로 사용한 경우는 많지 않다. 이는 속실렛 추출법을 사용하 기 위해서는 다른 추출 방법에 비해 많은 시료가 필요하고 용 매또한 대량으로 사용하기 때문이다. 하지만, 속실렛 추출법 은 고무 제품 내잔존하는 전체 유기물을 모두 추출하여 유 기물 총량을 분석하거나 미가교 고분자 성분을 추출하는데 유 용하게 사용되고 있다.83,84 Scuracchio 등은 NR, SBR, BR 등 으로 구성된 타이어 고무를 속실렛 추출하여 겔 함량을 결정 하였으며, Ozdemir 등은 붕산과 함께 배합한 EPDM의 가교 도를 결정하기 위해 속실렛 추출법을 사용하였다.83,84
| Rubber | Solvent | Extracted Substance | Reference |
|---|---|---|---|
| Elastomer | acetone | BHT, Cyanox 2246, Antioxidant OMB, Cyanox 425, OTBG, DPG, DOTG, TPG | 86, 87 |
| acetone and ammonia | mercapto group | 86 | |
| SBR | acetonitrile | HPPD, OBTS, TMQ, processing oil, paraffin wax | 75, 85 |
| acetone | HPPD, TMQ, DODPA, paraffine oil, t-octylphenol/formaldehyde resin | 75, 85 | |
| IIR | chloroform | alkane, palmitic acid, stearic acid, BHT, DIBP | 73 |
| toluene | toluene, xylene, bibenzyl, diphenylethylene | 73 |
Cyanox 2246: 2,2’-methylenebis(4-methyl-6-tert-butylphenol), Antioxidant OMB: 2,2'-methylenebis[6-(1,1-dimethylethyl)-4-methyl-phenol, Cyanox 425: 2,2’-methylenebis(4-ethyl-6-tert-butylphenol), OTBG: orthotolybiguanidine, DPG: diphenylguanidine, DOTG: diorthotolyguanidine, TPG: triphenylguanidine, OBTS: N-oxydiethylene-2-benzothiazylsulfenamide, DODPA: di-(t-octyl)-diphenylamine, DIBP: diisobutyl phthalate
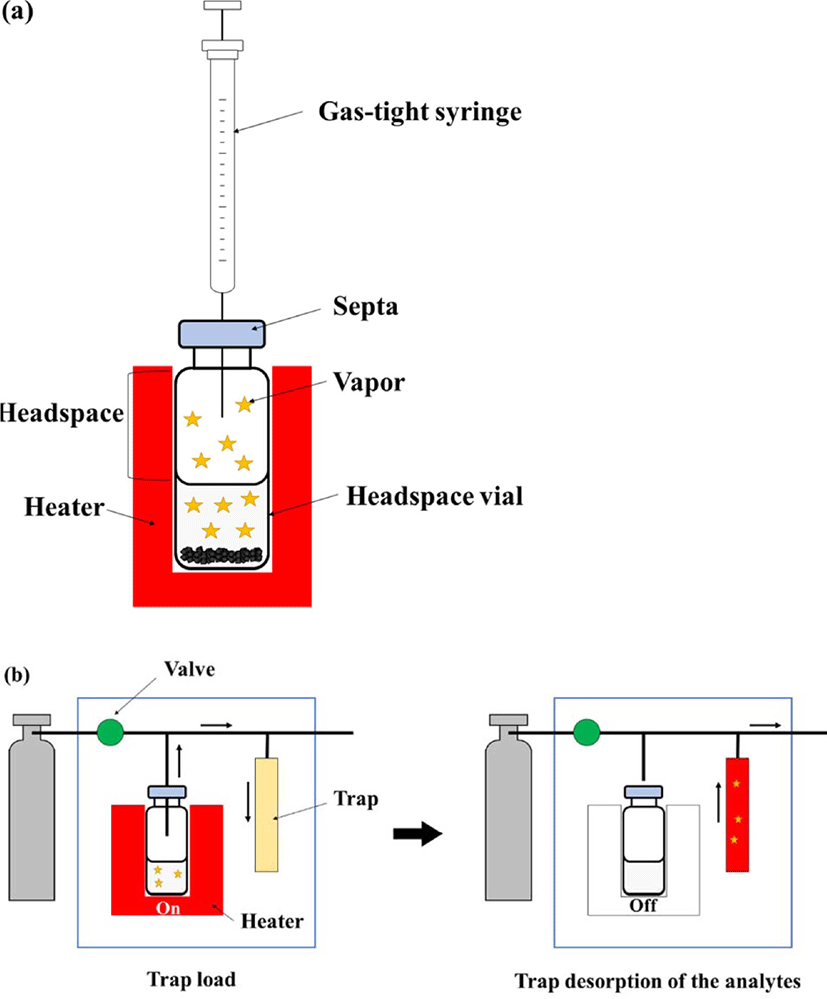
헤드 스페이스는 바이알에서 용매 위의 공간 부분을 의미 하며 (Figure 4), 헤드 스페이스에 있는 유기물 증기를 채집하 는방법이 헤드 스페이스 추출법이다. 따라서, 헤드 스페이스 추출법은 휘발성이 높은 저분자량 유기물을 추출하는데 유용 한방법이다. 헤드 스페이스에서 분석물의 농도는 시료상 (용 액)과 기체상 사이의 분석물의 평형 분포로 정의되는 분배 계 수(K)를 통해 결정할 수 있다.88 낮은 K값을 갖는 화합물은 쉽 게 기체가 되려는 경향이 있으며 우수한 검출 한계를 갖는다. K값은 바이알이 평형상태가 되는 온도를 변화시키거나 무기 염을 이용함으로써 낮출 수 있다.
헤드 스페이스는 정적 헤드 스페이스 (SHS)와 동적 헤드스 페이스(DHS)로나눌 수있다 (Figure 4). SHS 는 시료를 바이 알에 넣고 캡으로 밀봉한다.87 이때캡에 있는 격막(septum)은 PTFE 등의 비활성 재질로 되어있다. 밀봉된 바이알에 열을 가 하면 시료 중 휘발성 물질이 헤드 스페이스 (시료와 캡 사이의 공간)로 휘발된다. 휘발 과정은 시료 중에 존재하는 유기물과 헤드 스페이스에 존재하는 유기물이 상평형을 이룰 때까지진 행된다.89 비휘발성 시료에서 휘발성 성분을 추출하여 바이알 의 헤드 스페이스에서 분리 가능하다.90 채취한 휘발성 성분 을 분리 분석하기 위해 GC 와 같은 분석기기에 옮기는 기술 중 gas tight syringe 를 이용한 것이 있다. 이기술은 평형상태 에도달할 때까지 주어진 시간과 온도 동안 오븐에 시료를 둔 후, 시료가 평형에 도달하면 gas tight syringe 를 사용하여 헤 드 스페이스에서 분석물을 채취하여 GC 에 주입하는 것이다. 휘발성 물질의 헤드 스페이스로의 이동을 향상시키기 위해 온 도나 시간 등을 조절해야 한다. 이때, 분석물이 시린지 내에 서 재응축 되지 않도록 시린지를 따뜻하게 하는 것이 중요하 다.88 SHS는 시료가 있는 바이알의 헤드 스페이스에서 직접 분 석물을 채취함으로써 시간과 비용을 줄일 수 있다. 액상, 고 상, 에멀젼 형태의 시료에 모두 적용이 가능하다.91
DHS는 퍼지 앤 트랩이라고도 불린다.89 DHS는 SHS 와 달 리 분석물질 채취를 위하여 비활성기체를 사용한다. 가장 비 용적으로 효율적인 시스템은 적절한 흡착제가 채워진 카트리 지 혹은 트랩을 이용하는 것이다.91 시료가 담긴 바이알은 일 반적으로 히터 안에 놓여있으며, 비활성기체를 흘려주어 비 활성기체가 시료를 휩쓸 수 있게 한다. 비활성기체를 적절하 게 조절하면 헤드스페이스에 제법많은 양의 휘발성 물질이 모이게 된다. 이 과정으로 생성된 분석물을 트랩에포집하고 비활성기체는 배출시킨다. 트랩의 흡착제는 실온에서 화합물 을 효과적으로 포집하고 상승된 온도에서 화합물을 방출한 다. 주로 사용되는 흡착제는 Tenax, 실리카 겔, 그리고 숯 등 이다.92 DHS는 분석 및 분리 시스템에 주입되기 전 화합물을 농축함으로써 SHS 의 감도 한계를 극복할 수 있다.
Table 5 에 헤드 스페이스 추출법을 이용한 고무 소재의 추 출에 대한 예를 SHS 와 DHS 로나누어 정리하였다.73,93-97 Kamarulzaman 등은 NR 을 SHS 와 DHS로 각각 추출하여 비 교하였다.95 DHS에서는 헬륨을 퍼지 가스로 사용하였고, Tenax 로 충진된 트랩을 사용하였다. 추출된 화합물들은 GC/MS로 분석하였다. SHS로 추출한 결과, 추출 온도가 높아지 면서 추출되는 화합물의 종류가 달랐다. 30°C 에서는 trimethylamine, butanone, acetone, methyl isovalerate, dimethyl disulfide 등이 확인되었고, 60°C 에서는 ethylbenzene, phenol, anisole 등의 방향족 화합물이 검출되었다. DHS 로 추출한 결과, 30°C 에서 방향족, 테르펜, 케톤 및 산을 포함한 휘발성 유기물이 검출되었으며, 60°C 에서는 indole-3-methyl, hexanoic, dodecane 과 같은 높은 끓는점의 화합물이 관찰되었다. DHS 를 이용하 여 추출 분석할 시 SHS 를 이용했을 때보다 더많은 화합물 을 검출할 수 있었다. Trowell 등은 SHS 를 적용하여 EPDM 에서 잔류 tert-butanol 을 GC-FID를 이용하여 분석하였다.96
| Type | Rubber | Extracted Substance | Reference |
|---|---|---|---|
| Static | IIR | alkane, BHT, xylene, bibenzyl, diphenylethylene | 73 |
| ABS | 1,3-butadiene, styrene, acrylonitrile | 94 | |
| NR | TMA, dimethyl disulfide, butanone, methyl isovalerate | 95 | |
| EPDM | butyl alcohol | 96 | |
| Dynamic | NR | siloxane, xylene, isobutene isomer, N-methyl aminobenzene | 93 |
| TMA, hexanenitrile, dimethyl disulfide, butanoic propanoic, anisole, phenol | 95 | ||
| Silicon rubber | BHT, trimethylhydroxysilane, hexamethylcyclotrisiloxane, 2-methylnonane, octamethylcyclotetrasiloxane, Tetrakis(trimethylsiloxy)silane, Decamethylcyclopentasiloxane, Dodecamethylpentasiloxane, 1,2,4,5-tetramethylbenzene, Dodecamethylcyclohexasiloxane, Tetradecamethylcycloheptasiloxane, | 97 |
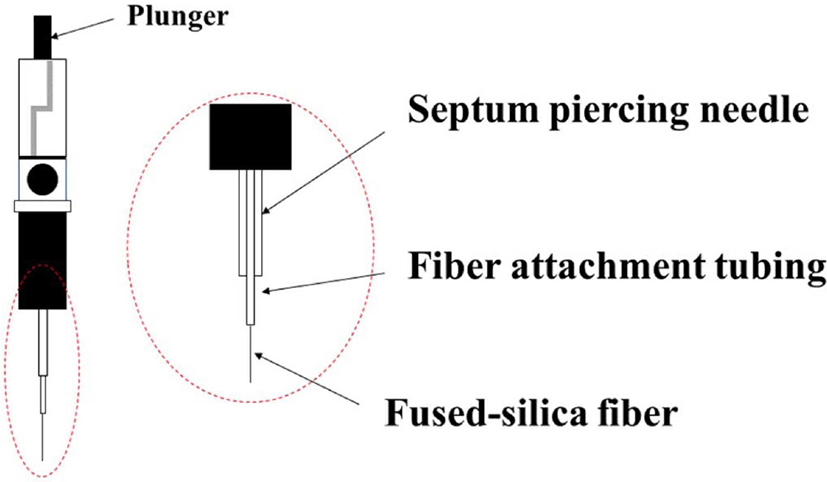
고상미세추출법(SPME)은 섬유에 분석물질이 흡수및 흡착 되는 단계와 분석물질을 코팅제에서 탈착하는 단계로 이루어 진다.98 SPME에서 섬유는 코팅되어 있으며 첫 번째 과정에서 코팅된 섬유는 시료에 노출되고, 분석 유기물은 시료에서 코 팅된 섬유로 전이되어 추출된다. 분석물이 농축된 섬유는 탈 착을 위한 기구로 옮겨지고 이어서 분석이 진행된다. Figure 5는 SPME 에 사용되는 시린지이다. SPME의 시린지에서 플 런저는 코팅된 용융 실리카 섬유를 속이 빈 바늘 안팎으로 이 동시킨다.99 추출을 하기 위해서는 바늘로 바이알을 밀봉하는 격막을 통과시키고 플런저를 눌러 액체 시료 혹은 헤드스페 이스에 용융 실리카 섬유를 노출시킨다. 분석물질은 섬유에 흡착된다. 보통 2-30 분 내에 흡착 평형이 이루어진다. 그 후 플런저를 이용해 섬유를 속이 빈 바늘로 올리고 바늘을 바이 알에서 분리시킨다. 용융 실리카 섬유는 비교적 얇은 고분자 필름으로 코팅된다.100 용융 실리카 섬유 자체는 화학적으로 불활성이며 고온에서도 매우 안정적이다.101 이 때 사용하는 코팅된 섬유의 종류가 추출물질의 선택에 영향을 미친다.102
용융 실리카 섬유에 코팅되는 소재는 GC 의 모세관 컬럼의 정지상과 유사하다.99 가장 널리 사용되는 코팅 소재는 polydimethylsiloxane (PDMS) 이다. PDMS 는비극성 화합물의 추 출에 적합하다. Polyacrylate (PA) 는 극성 코팅제이며 페놀 추 출에 적합하다. CAR(carboxen)/PDMS는 기체 및 휘발성 물 질, CW (carbowax, polyethylene glycol)/DVB (divinylbenzene) 는 극성물질 중에서도 특히 알코올 추출에 적절하다. 저분자 량 또는 휘발성 화합물 추출에는 일반적으로 100 μm PDMS 코팅 섬유가 사용된다.100 더큰 분자량 또는 반 휘발성 화합 물은 30 μm PDMS 혹은 7 μm PDMS 섬유로 보다 효과적으 로 추출할 수 있다. 일반적인 극성 시료에서 극성 물질을 추 출하기 위해서는 85 μm PA 코팅 섬유를 사용한다. 알코올이 나 아민과 같은 보다 휘발성인 극성 물질은 65 μm PDMS/DVB 코팅 섬유에 효과적으로 흡착된다. 코팅된 섬유는 시료 에 따라 20-150번 혹은 그 이상 사용이 가능하다.102 SPME에 사용되는 코팅 섬유는 분석물질에 대한 친화력을 가지고 있 기 때문에 농축효과가 좋고 이는 우수한 감도를 만든다.101
Figure 6 에 SPME 의 두 가지 추출유형을 나타내었다. 하나 는 direct immersion SPME (DI-SPME)이고, 다른 하나는 headspace SPME (HS-SPME) 이다. 두 방법의 차이점은 DISPME는 섬유가 액체 추출 시료에 직접 담기는 것이고, HS-SPME에서 섬유는 헤드스페이스에 노출되어 휘발성 물질을 흡착한다는 것이다.103 DI-SPME 에서 분석물질의 신속한 추출 을 위해 일정 수준의 교반이 필요하다.104 HS-SPME는 고체 시 료에서 휘발성인 분석물질을 추출하는데 용이하며 매우복잡 한 시료로부터 분석물을 추출할 수 있다.91,101 DI-SPME 와비 교했을 때, HS-SPME 는 분석물질의 확산을 방해하는 용매가 없기 때문에 평형이 더 빠르게 이루어진다. SPME 는단순성, 저렴한 비용, 간편한 자동화 및 현장 샘플링과 같은 장점을 가 진다.101 무엇보다도 시료 채취, 추출, 농축 및 시료 도입을 단 일 단계로 통합하여 시료 준비 시간을 단축할 수 있다.99 용매 를 사용하지 않기 때문에용매 효과를 배제할 수있고, 폐기 물 처리에 대한 추가적 비용을 절감할 수 있다. 하지만 SPME 에서 강한 유기용매에 안정적이고 내구성 있는 섬유가 없기 때문에 HPLC 응용에는 제한적이다.100
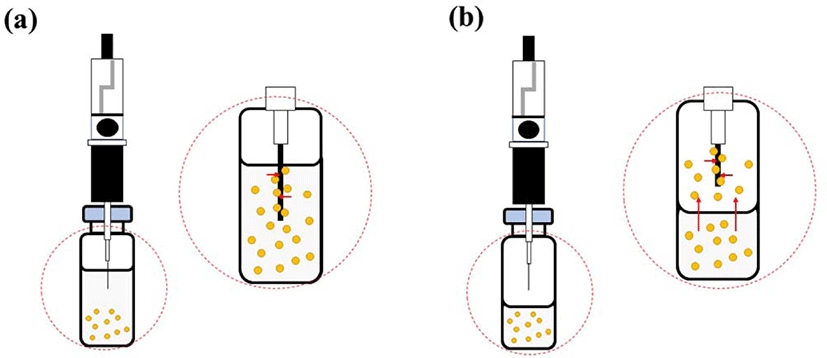
Table 6에 SPME 를 적용한 고무 소재의 추출을 정리하였 다.95,97,105,106 SPME 를 사용한 대부분이 HS-SPME 를 택하였 다. 이는 DI-SPME 의 경우 용매를 사용하기 때문에용매의간 섭 등의 영향을 배제시킬 수 없는데 HS-SPME 는용매를 쓰 지 않기 때문에 더많이 추출에 적용된다. Feng 등은 실리콘 고무 소재 추출에 HS-SPME 를 사용하였다.97 분석에 이용한 코팅된 섬유는 DVB/CAR/PDMS, PDMS/DVB, CAR/PDMS, PDMS이다. 70°C 에서 50 분 동안 헤드 스페이스에 섬유를 노출 시키고, GC 주입구에서 3분 동안 열탈착시켰다. 이렇게 추출 된 물질을 GC/MS 로 분석하였다. DVB/CAR/PDMS 섬유에서 많은 화합물이 추출되었고, PDMS 섬유에서 가장 적은 화합물 이 추출되었다. 섬유에 추출된 화합물을 GC/MS 로 분석한 결 과, tetradecane, hexadecane, tridecane 등의 알켄 화합물, methyl laurate, ethyl hexanoate 등의 에스터 화합물, nonanal, benzaldehyde, decanal 등의 알데하이드 화합물, 그리고 benzothiazole와 N,N-dibutylforamide 등이 검출되었다.
| Rubber | Coating Fiber | Extracted Substances | Reference |
|---|---|---|---|
| NR | DVB/CAR/PDMA, CAR/PDMS, PDMS/DVB, PDMS | TMA, hexanenitrile, 3-methyl-indole, indole, nonanone, anisole, aniline, o-cymene, styrene, ethylbenzenen, m-xylene, D-limonene | 95, 105 |
| DVB/CAR/PDMS, CAR/PDMS | hexanal, dodecadienone | ||
| Silicone rubber | DVB/CAR/PDMA, CAR/PDMS, PDMS/DVB, PDMS | alkane(C11-C17), tridecane, hexadecane, teradecane, pentadecane, 2,6,10-trimethyldodecane, 2-methyltridecane, 2,6,10-trimethylpentadecane, siloxane, N, N-dibutylformamide, BHT | 97 |
| IR | DVB/CAR/PDMS, CAR/PDMS | pentanal, 1-ethyl-5-methylcyclopentane, hexanal, dimethyl phthalate | 105 |
| Polysiloxane | PDMS | hexamethylcyclotrisiloxane, octamethylcyclotetrasiloxane, decamethylcyclopentasiloxane, dodecamethylcyclohexasiloxane, tetradecamethylcycloheptasiloxane | 106 |
Example for Analysis of the Extract Using Gas Chromatography/Mass Spectrometry
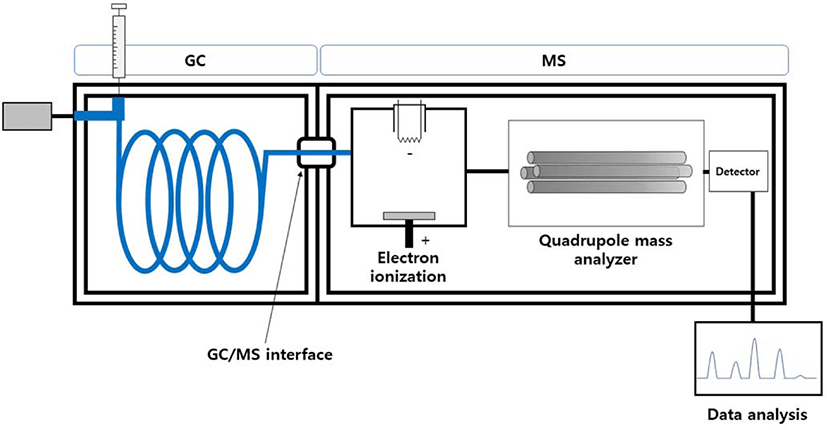
Figure 7 은 GC/MS 의 모식도이다. GC 에서 분리된 분석물질 은 고온의 interface 를 지나 MS 로 이동한다. MS 는 크게 이온 화 영역, 질량분석기(mass analyzer), 그리고 검출기로 나눠져 있다. GC/MS 에서는 분리된 시료를 이온으로 만들기 위한 이 온화 방법으로주로전자 이온화 (electron ionization, EI) 가사 용된다. EI 는 고에너지 이온화 방법으로 많은토막 이온을 만 든다. GC/MS에서는 형성된 이온을 질량 -대-전하비(m/z)에 따 라 분리시키는 질량분석기로 사중극자 질량분석기 (quadrupole mass spectrometer) 를 가장 많이 사용하고 있다. Figure 8 은용 매 추출법을 이용하여 추출한 NR 가황물의 유기물 추출 전 과 후의용액 상태를 보여준다. 추출을 위해서 고무를 1 mm 이하의 크기로 자른후, 2 mL 바이알에 50 mg 을 넣었다. 추 출용매로 1 mL 의 클로로폼을 사용하였고 50°C 오븐에서 5 시간 동안 추출하였다.

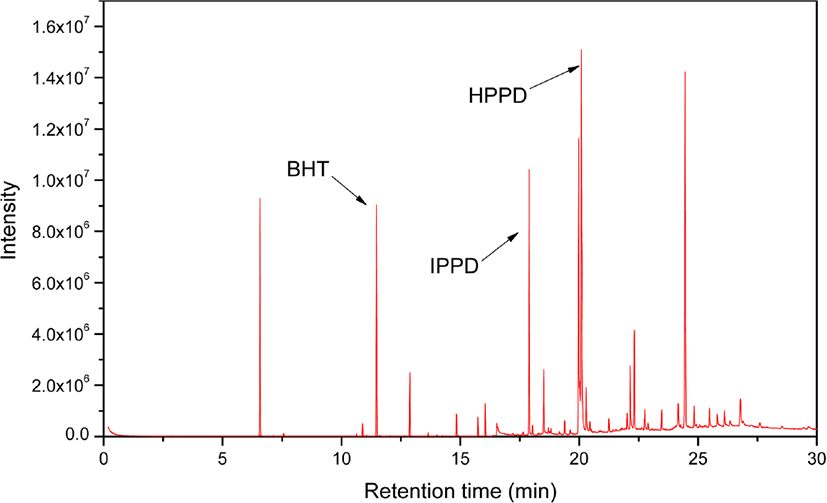
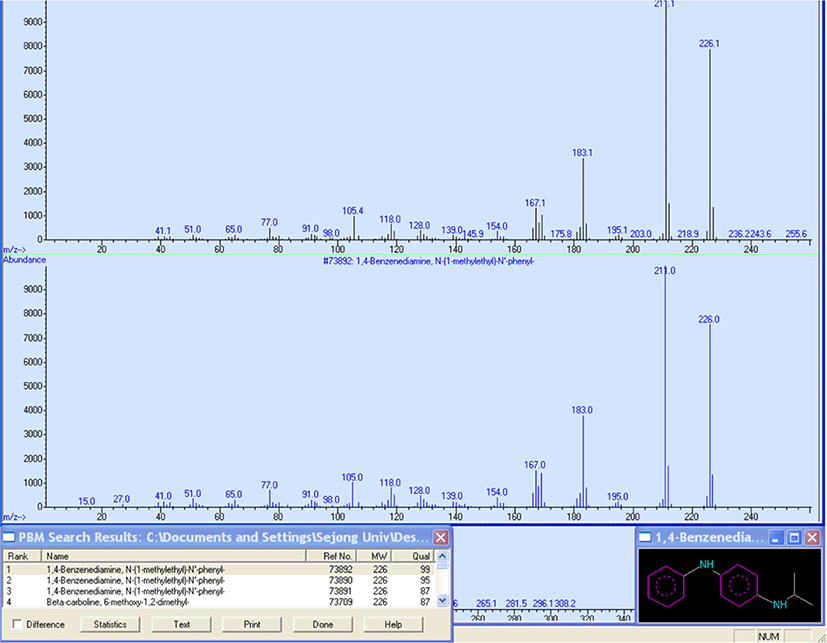
추출물을 1 μL 주입하여 GC/MS 로 분석한 크로마토그램을 Figure 9 에 나타냈다. GC/MS 에서 얻는 크로마토그램의 피크 세기는 전체 검출된 이온에 대한 것으로 total ion current chromatogram (TIC) 라고 부른다. GC/MS 를 사용하면 빠른 시 간에 추출물을 각 성분으로 분리하고 각 성분의 화학 구조를 규명할 수있다. 질량분석법은정성 및정량분석에 있어 감 도가 높은 분석 방법으로 라이브러리 비교 혹은 질량 스펙트 럼 해석을 통해 분석물질을 규명할 수 있다는 장점이 있다. Figure 10 은 17.90 분에 나타난 분석물의 질량 스펙트럼을 라 이브러리에서 검색한 결과를 보여준다. MS 의 데이터 프로그 램은 분석한 질량 스펙트럼을 라이브러리와 비교하여 그결 과를 보여주는데, match quality 값을 확인하여야 한다. Match quality란 라이브러리와 분석 결과를 대조하여 얼마나 일치하 는 지에 대해퍼센트로 나타낸것이다. Match quality 가 95% 이상인 경우에는 물질을 확실하게 특정할 수 있다. Match quality가 95-90%인 경우에는 질량 스펙트럼을 재확인하는 것 이 필요하다. Match quality 가 90% 이하일 경우에는 실제와 차이가 있을 수 있기 때문에정밀한 질량 스펙트럼 해석이 필 요하다. Figure 10 은 match quality 가 99% 이다. 따라서 17.90 분의 피크는 IPPD 라고 할 수 있다.
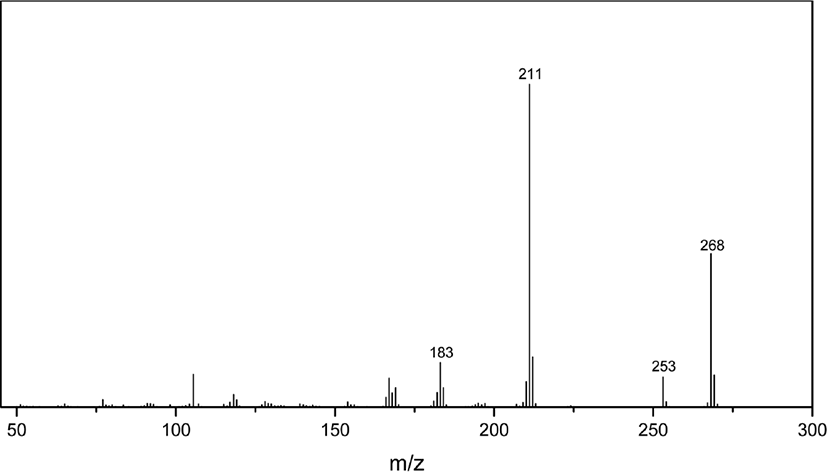
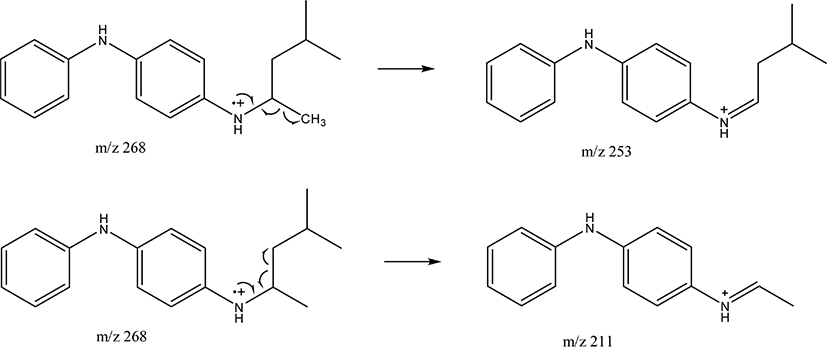
라이브러리로 확인할 수 없는 경우에는 질량 스펙트럼을 직 접 해석하여 미지 시료의 화학 구조를 규명할 수 있다. 질량 스펙트럼의 해석은 분자이온의 쪼개짐 패턴을 통해 할 수 있 다. Figure 11 은 19.98분 피크의 질량 스펙트럼인데, 라이브러 리로 확인할 수 없는 경우로 가정한다. 특징적인 이온들은 m/z 268, 253, 211 이다. 이중 m/z 268 은 분자이온 피크이고, m/z 253 은 분자 이온과의 질량 차이가 15 이므로 메틸기 (CH3) 가 떨어진 것이며, m/z 211 은 분자 이온과의 질량 차이가 57 로 부틸기 (C4H9)가 떨어진 것으로 해석 가능하다. Figure 12 에 HPPD 의 쪼개짐 메커니즘을 나타냈는데, 이와 비교하면 19.98분 피크는 HPPD 로 해석될 수 있다.
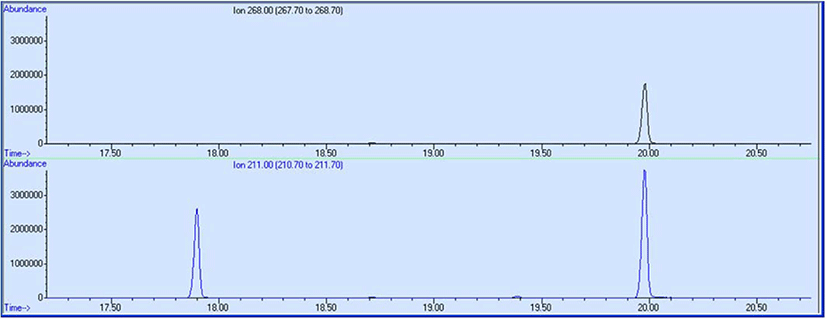
고무 제품의 추출물에는 다양한 성분이 포함된다. 추출물 중 특정 물질의 존재 여부를 확인하고 싶을 때에는 extracted ion chromatogram (EIC) 을 사용하면 편리하다. EIC 는 특정한 m/z 값을 갖는 분석물에 대한 크로마토그램이다. 이는 분석 시 료에 특정한 물질의 존재 여부를 확인할 때 사용할 수있다. 예를 들어, 추출물에서 HPPD 의 존재를 확인하고 싶다면, HPPD의 분자이온인 m/z 268 과 최대 피크인 m/z 211 의 EIC 를 얻는다. EIC에서는 선정된 m/z 값을 갖는 피크만이 나타 난다. Figure 13 은 m/z 268 과 m/z 211 의 EIC 를 보여준다. m/z 211 의 EIC 에는 m/z 268 과 동일한 머무름 시간과 다른 머무 름 시간에 2개의 피크가 나타났다. 한 이온의 EIC 에서 2개 이 상의 피크가 나올 수 있기 때문에 보다 정확한 확인을 위해 서는 3개 이상의 이온을 선정하는 것이 바람직하다. 동일한 머 무름 시간에 나타난 2개의 EIC 피크에 대한 질량 스펙트럼은 동일하고 이를 해석하면 HPPD 임을 확인할 수 있다.